2.3.3. Органические вещества клетки. Белки.
2.3.3. Органические вещества клетки. Белки.
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
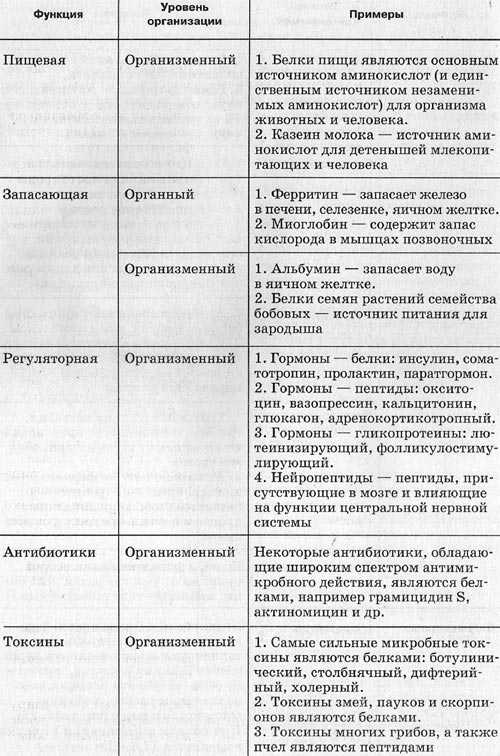
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы – ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
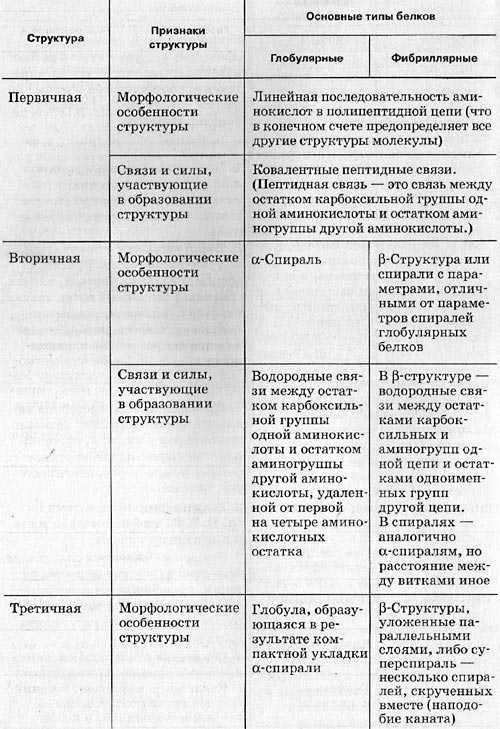
1.Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны
2.Длинная молекула белка сворачивается и приобретает сначала вид спирали – вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие цепь.
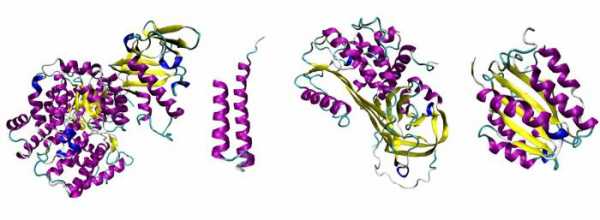
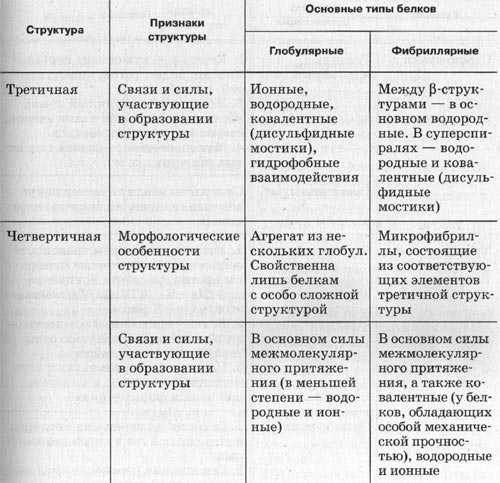
3.Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными
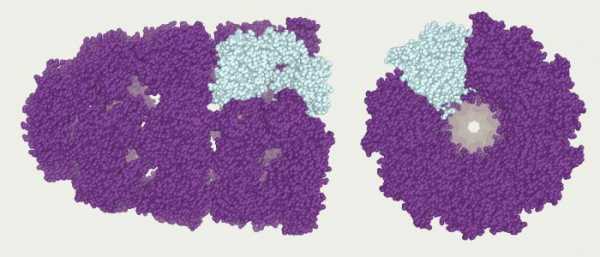
4.Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными.
Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
Белки имеют
Таблица. Образование структур (уровня пространственной организации) белков.
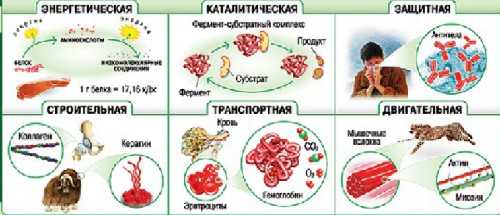
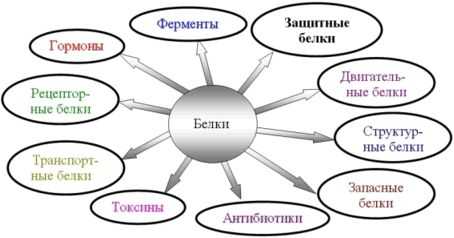
Функции белков.
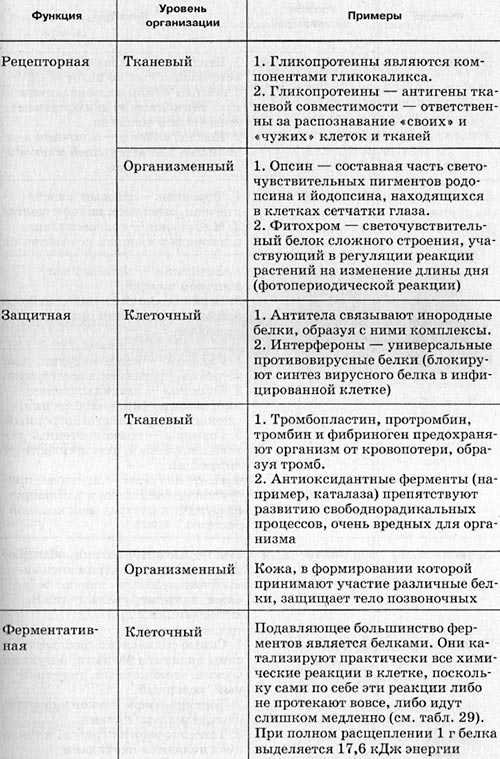
Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
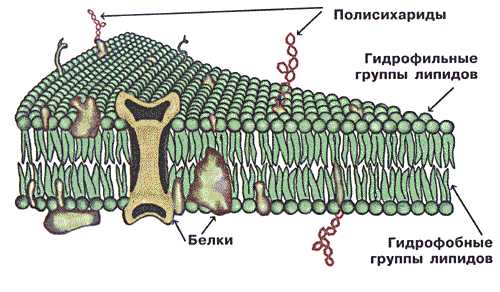
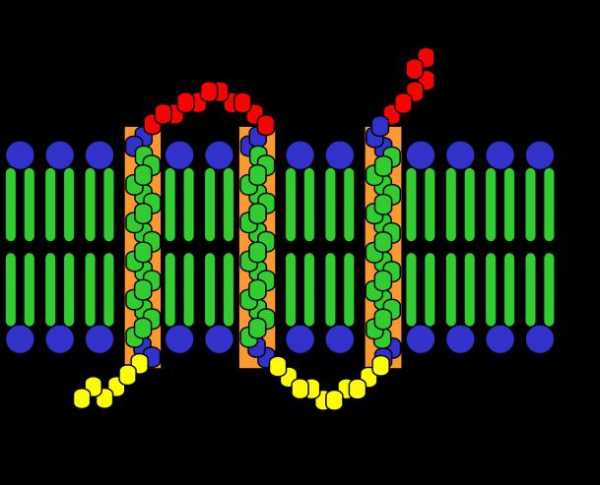
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
Таблица. Основные функции белков и пептидов.

Тематические задания.
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:
1) структуры гена
2) внешней среды
3) их случайного сочетания
4) их строения
А2. Человек получает незаменимые аминокислоты путем
1) их синтеза в клетках
3) приема лекарств
2) поступления с пищей
4) приема витаминов
А3. При понижении температуры активность ферментов
1) заметно повышается
3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует
1) гемоглобин
2) коллаген
3) фибрин
4) миозин
А5. В каком из указанных процессов белки не участвуют?
1) обмен веществ
2) кодирование наследственной информации
3) ферментативный катализ
4) транспорт веществ
А6. Укажите пример пептидной связи:
Часть В
В1. Выберите функции, характерные для белков
1) каталитическая
2) кроветворная
3) защитная
4) транспортная
6) фотосинтетическая
В2.
Установите соответствие между структурой белковой молекулы и ее особенностями
|
ОСОБЕННОСТИ СТРУКТУРЫ |
СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ |
|
|
|
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4. Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их.
1) Большая часть химических реакций в организме катализируется ферментами.
2) Каждый фермент может катализировать множество типов реакций.
3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует.
5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком.
6) За одну секунду уреаза расщепляет до 30000 молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн. лет.
biology100.ru
белки — урок. Биология, Общие биологические закономерности (9–11 класс).
Белки (протеины, полипептиды) — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты, которые (имея в своём составе карбоксильную и амино- группы) обладают свойствами кислоты и основания (амфотерны).
Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры и их называют макромолекулами.
Структура белковой молекулы
Под структурой белковой молекулы понимают ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего 20 видов различных аминокислот и огромное разнообразие белков создается за счет различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка (она уникальна для любого белка и определяет его форму, свойства и функции). Первичная структура белка уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль — вторичная структура белка.
- Третичная структура белка — трёхмерная пространственная “упаковка” полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S-S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией.
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки — ферменты — способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция — одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия).
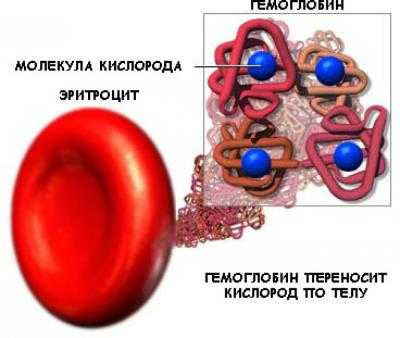
- Транспортная функция — белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).
- Сигнальная функция. Прием сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция — обеспечивается сократительными белками – актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов.
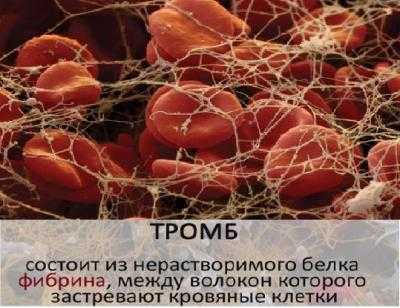
- Защитная функция — антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.
- Регуляторная функция присуща белкам — гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция — при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источники:
Каменский А. А., Криксунов Е.А., Пасечник В.В. Биология. 9 класс // ДРОФА
Каменский А. А., Криксунов Е.А., Пасечник В.В. Биология. Общая биология (базовый уровень) 10-11 класс // ДРОФА
Лернер Г.И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель
http://ours-nature.ru/lib/b/book/1063747118/348
www.yaklass.ru
Виды белков, их функции и структура
По теории Опарина-Холдейна жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения — основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
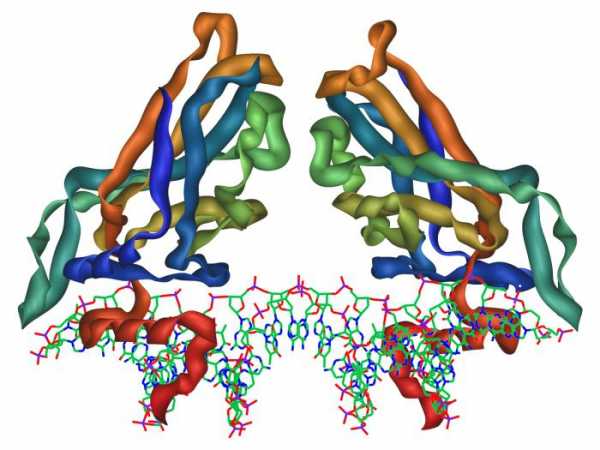
Белки: общее понятие
С точки зрения химического строения, молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
- карбоксильную -СООН;
- амино-группу -NH2.
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы — ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в сыром виде. Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток — это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.
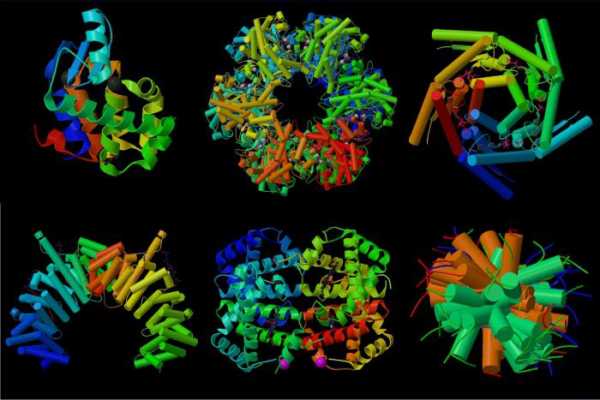
Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды структур белка определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой — глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей — это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур — альбумин, фиброин, белок шелка и прочие.
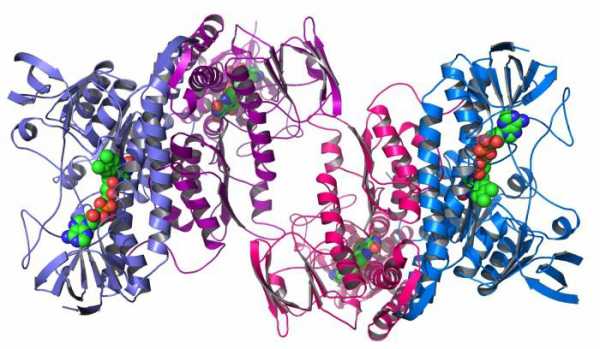
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.

Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся «белок» — это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.
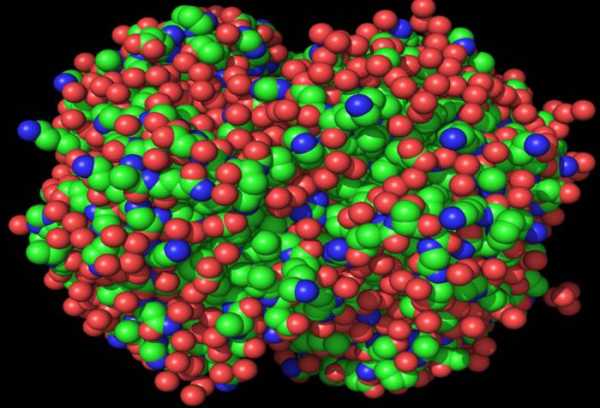
Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство — гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения — гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример — глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними «в бой», выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные — те, что содержат все необходимые для организма аминокислоты;
- неполноценные — те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- соя;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.
Белки в клетке
Внутри самой маленькой структурной единицы всего живого — клетки — также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных видов протеинов, которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.
- Глобулярные белки. Это такие, которые представлены третичной структурой, то есть плотно упакованной глобулой. Примеры таких структур следующие: иммуноглобулины, значительная часть ферментов, многие гормоны.
- Фибриллярные белки. Представляют собой строго упорядоченные нити, имеющие правильную пространственную симметрию. К данной группе относятся протеины с первичной и вторичной структурой. Например, кератин, коллаген, тропомиозин, фибриноген.

Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен веществ просто невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы — это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.
fb.ru
что это? Функции белков и биосинтез в организме человека
Белки являются важнейшими химическими соединениями, без которых жизнедеятельность организма была бы невозможной. Из белков состоят ферменты, клетки органов, тканей. Они отвечают за обменные, транспортные и многие другие процессы, проходящие в человеческом теле. Белки не могут накапливаться «про запас», поэтому должны регулярно поступать в организм. Особенное значение они имеют для людей, занимающихся спортом, ведь белки регулируют двигательные функции организма, ответственны за состояние мышц, сухожилий, костей.

Содержание статьи
Что такое белки?
Белки – это высокомолекулярные сложные органические соединения, состоящие из остатков аминокислот, соединённых особым образом. У каждого белка своя индивидуальная последовательность аминокислот, своё расположение в пространстве. Важно понимать, что белки, поступающие в организм, не усваиваются им в неизменной форме, они расщепляются до аминокислот и с их помощью организм синтезирует свои белки.
В образовании белков принимают участие 22 аминокислоты, 13 из них может превращаться одна в другую, 9 – фенилаланин, триптофан, лизин, гистидин, треонин, лейцин, валин, изолейцин, метионин – являются незаменимыми. Недостаток поступления в организм незаменимых кислот недопустим, это приведёт к нарушению жизнедеятельности организма.
Важен не только факт поступления белка в организм, но и то, из каких аминокислот он состоит!
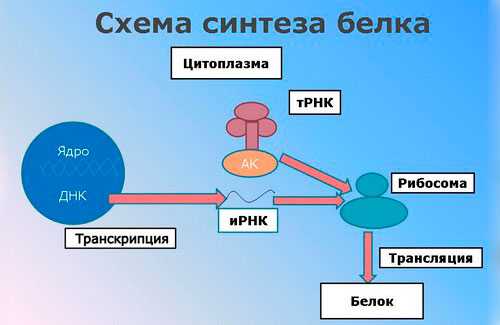
Биосинтез белка в организме
Биосинтез белка – образование в организме нужных белков из аминокислот путём их соединения особенным видом химической связи – полипептидной цепочкой. Информацию о структуре белков хранит ДНК. Собственно синтез происходит в специальной части клетки, называемой рибосомой. Информацию от нужного гена (участка ДНК) к рибосоме передаёт РНК.
Поскольку биосинтез белка многостадиен, сложен, использует информацию, заложенную в основе человеческого существования – ДНК, то химический его синтез является трудной задачей. Учёные научились получать ингибиторы некоторых ферментов и гормонов, однако важнейшей научной задачей является получение белков с помощью генной инженерии.

Функции белков в организме
Представленная квалификация условна, ведь часто один и тот же белок выполняет несколько функций:
Структурная
Белок входит в состав частей органелл и цитоплазмы любой клетки человеческого организма. Белки соединительной ткани отвечают за состояние волос, ногтей, кожи, сосудов, сухожилий.
Ферментативная функция
Все ферменты являются белками.
Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
Каталитическая
Почти все 3000 ферментов, известные человечеству, состоят из белка. Большинство из них участвует в процессах расщепления пищи на простые составляющие, они же отвечают за доставку энергии к клеткам.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Гормональная
Гормоны представлены белками, они отвечают за регулирование сложных биохимических реакций человеческого организма.
Транспортная
Транспортная функция специального белка крови – гемоглобина. Благодаря этому белку осуществляется доставка кислорода от лёгких к органам и тканям организма.
Защитная
Заключается в деятельности белков иммунной системы, называемых антителами. Именно антитела стоят на страже здоровья организма, защищая его от бактерий, вирусов, ядов, позволяют крови образовывать сгусток на месте открытой раны.
Сигнальная функция белков заключается в передаче сигналов (информации) между клетками.
Сократительная
Любое движение человека – сложная сбалансированная работа мышц. За слаженное сокращение мышц отвечают специальные белки миозин и актин.

Источники белков: животные и растительные белки
Источники белка животного происхождения:
Источники белка растительного происхождения:
- бобовые – соя, фасоль, чечевица;
- орехи;
- картофель;
- крупы – манка, пшено, перловка, гречка.
Нормы белка для взрослого человека
Потребность человеческого организма в белке напрямую зависит от его физической активности. Чем больше мы двигаемся, тем более быстро протекают в нашем организме все биохимические реакции. Людям, которые регулярно тренируются, требуется белка почти вдвое больше, чем среднестатистическому человеку. Недостаток белка для людей, занимающихся спортом опасен «иссушением» мышц и истощением всего организма!
В среднем норма белка для взрослого человека рассчитывается исходя из коэффициента 1 г белка на 1 кг веса, т. е. примерно 80–100 г для мужчин, 55–60 г для женщин. Спортсменам-мужчинам рекомендуется увеличивать количество потребляемого белка до 170–200 г в сутки.

Правильное белковое питание для организма
Правильное питание для насыщения организма белком заключается в сочетании белков животного и растительного происхождения. Степень усвоения белка из продуктов питания зависит от его происхождения и способа термической обработки.
Так, организмом усваиваются примерно 80% от общего поступления с пищей белков животного происхождения и 60% – растительного. В продуктах животного происхождения содержится большее количество белка на единицу массы продукта, нежели в растительных. Кроме того, в состав «животных» продуктов входят все аминокислоты, а растительные продукты в этом отношении считаются неполноценными.
Основные правила питания для лучшего усвоения белка:
- Щадящий способ кулинарной обработки – варка, приготовление на пару, тушение. Жарка должна быть исключена.
- Рекомендуется употреблять больше рыбы и птицы. Если очень хочется мяса – выбирайте говядину.
- Следует исключить из рациона бульоны, они жирны и вредны. В крайнем случае можно приготовить первое блюдо, используя «вторичный бульон».
Особенности белкового питания для роста мышц
Спортсменам, активно набирающим мышечную массу, следует придерживаться всех вышеизложенных рекомендаций. Большую часть их рациона должны составлять белки животного происхождения. Их следует употреблять в пищу совместно с растительными белковыми продуктами, из которых особое предпочтение нужно отдать сое.
Читайте подробнее какая пища богатая белком.
Необходимо также проконсультироваться с врачом и рассмотреть возможность употребления специальных протеиновых напитков, процент усвоения белка из которых равен 97–98%. Специалист индивидуально подберёт напиток, рассчитает верную дозировку. Это станет приятным и полезным белковым дополнением к силовой тренировке.
Особенности белкового питания, желающим похудеть
Желающим похудеть следует употреблять в пищу животные и растительные белковые продукты. Важно разделить их приём, т. к. время их усвоения разное. Следует отказаться от жирных мясных продуктов, не стоит злоупотреблять картофелем, нужно отдать предпочтение крупам со средним содержанием белка.
Не стоит вдаваться в крайности и «садиться» на белковую диету. Она не всем подходит, ведь полное исключение углеводов приведёт к снижению работоспособности и энергии. Достаточно есть продукты, содержащие углеводы, утром – это придаст энергии в течение дня, во второй половине дня употребляйте белковую нежирную пищу. Для восполнения недостатка энергии вечером организм начнёт сжигать жировые отложения, вместе с тем процесс этот будет безопасен для здоровья организма.
Обязательно включайте нужные и правильно приготовленные белковые продукты в свой рацион. Для организма белок – основной строительный материал! Вкупе с регулярными тренировками, он поможет вам построить красивое спортивное тело!
Загрузка… Белки – их роль в организме человека и на сколько они важны в спортеБелки являются важнейшими химическими соединениями, без которых жизнедеятельность организма была бы невозможной. Из белков состоят ферменты, клетки органов, тканей. Они отвечают за обменные, транспортные и многие другие процессы, проходящие в человеческом теле. Белки не могут накапливаться «про запас», поэтому должны регулярно поступать в организм. Особенное значение они имеют для людей, занимающихся спортом, ведь белки регулируют …
Оценка читателей: 4.21 ( 7 голосов) 0athleticbody.ru
строение и биологические функции молекулы белка
Здравствуйте, мои дорогие читатели. С вами я, Галина Баева, и сегодня мы поговорим о строении и функциях молекул белка.
Зачем он нужен, этот белок? Может, без него обойдемся?
Нет, не обойдемся. Бородатый основатель диалектического материализма Фридрих Энгельс сказал: жизнь – есть способ существования белковых тел. Иначе говоря, белок – это жизнь, нет белка – увы и ах. В норме белок составляет 50%, т.е. половину от сухой массы клетки, а от сухой массы тела человека они составляют от 45%.
Особенности строения белков позволяют им проявлять различные свойства, чем обусловлены их разнообразные биологические функции
Белки иначе называют протеинами, это одно и то же.
Чем занимаются белки в организме?
- Протеины являются теми кирпичиками, из которых сложен наш организм. Они являются структурными элементами клеточных мембран (липопротеины, гликопротеины), и внеклеточных структур. Коллаген образует сухожилия, он же отвечает за упругость кожи, кератин образует волосы и ногти.
- Протеины транспортируют необходимые элементы по организму. Гемоглобин переносит кислород от легких ко всем органам и тканям, а от них – уносит углекислый газ, белок альбумин переносит жирные кислоты, особые белки таскают холестерин. В составе клеточных мембран имеются белки, которые обеспечивают перенос некоторых веществ и ионов из клетки во внеклеточное пространство и обратно.
- Гормоны – особые вещества, регулирующие процессы обмена веществ – имеют белковую природу. Например, гормон инсулин загоняет сахар из плазмы крови в клетки
- Протеины защищают организма от чужеродных агентов. Гамма — глобулины обезвреживают микробов, интерфероны подавляют размножение вирусов. Фибрин останавливает кровотечения.
- Протеины обеспечивают сокращение двигательной мускулатуры и других сокращающихся тканей. Актин и миозин входят в состав мышц тела, тропонин, тропомиозин – мышц сердца.
- Протеины принимают сигналы из внешней среды и передают команды в клетку. Под воздействием факторов внешней среды сигнальные белки изменяют свою третичную структуру, что в свою очередь запускает цепь биохимических процессов. Так родопсин реагирует на свет, преобразуя световую энергию в электрическую, которая передается по нервным клеткам в головной мозг, где формируется зрительная картинка.
- Протеины являются ферментами – катализаторами, благодаря которым возможно протекание биохимических реакций при низких температурах (370С).
- Протеины – регуляторы включают и выключают гены клетки, тем самым подавляя либо активируя биохимические процессы.
- Протеины, как правило, не накапливаются в организме, за исключением альбумина яйца и казеина молока. Лишних белков в организме нет. Однако, они могут соединяться с другими веществами и микроэлементами, препятствуя их выведению из организма. Так ферритин образует комплекс с железом, высвобождающимся при распаде гемоглобина, и вновь включает его в биологические процессы.
- Протеины могут давать энергию. При распаде 1 г. белка выделяется 4 ккал (17,6 кДж). В качестве источника энергии белки используются при истощении других, нормативных источников – углеводов и жиров. Перефразируя Д.И.Менделеева, можно сказать, что топить белками, это все равно что топить ассигнациями, настолько они ценны для организма.
Что представляет собой молекула жизни?
Это длинная цепочка, т.е. полимер, состоящая из мономеров – аминокислот. Почему аминокислот? Потому что у каждой молекулы есть хвост органической кислоты C-O-OH и аминогруппа NH2. В цепочке-полимере каждый мономер – аминокислота присоединяет свой кислотный остаток к аминогруппе другого мономера, получается прочная связь, именуемая пептидной.
Понятия белок и пептид близки, но не равнозначны. Обычно пептидами называют некоторую последовательность аминокислотных остатков. Выделяют олигопептиды – короткие цепочки в 10-15 аминокислот и полипептиды – длинные цепочки аминокислотных последовательностей. Белок – это полипептид, имеющий особую форму пространственной организации.
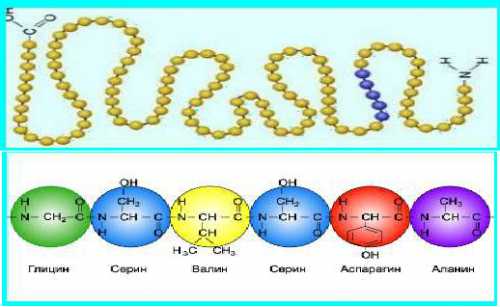
Нанизывая аминокислоты, как бусинки в ожерелке, формируется первичная структура белка, т.е. последовательность аминокислотных остатков.\
В пространстве белок существует не в виде вытянутой нитки, а завивается спиралью, т.е. формирует вторичную структуру.
Спиралька сворачивается в шарик – глобулу, это уже третичная структура белка.
Некоторые белки (не все) имеют четвертичную структуру, объединяя в своем составе несколько молекул, каждая со своей первичной, вторичной и третичной структурой.
Зачем это надо знать? Потому что переваривание и усвоение белка напрямую зависит от его структуры: чем плотнее упакован белок в составе пищевого продукта, тем тяжелее он поддается перевариванию, тем больше энергии надо затратить на его усвоение.
Распад связей в молекуле белка называется денатурацией. Денатурация может быть обратимой, когда белок восстанавливает структуру, и необратимой. Необратимой денатурации белки подвергаются в том числе при воздействии высокой температуры – для человека это свыше 420С, именно поэтому лихорадка опасна для жизни.
Мы подвергаем белки контролируемой денатурации в процессе приготовления пищи, когда варим мясо или рыбу, кипятим молоко, жарим или варим яйца, варим каши и печем хлеб. При мягком температурном воздействии, белки с распавшимися связями становятся более доступными для пищеварительных ферментов и лучше усваиваются организмом. При длительном и жестком температурном воздействии – жарке на углях, длительной варке – происходит вторичная денатурация белка с образованием трудноперевариваемых соединений.
Аминокислоты
Существует более двух сотен различных аминокислот, но в составе белков — полимеров постоянно встречаются лишь двадцать. Эти 20 «магических» аминокислот делятся на две неравные группы: заменимые, т.е. те, которые могут вырабатываться самим организмом, и незаменимые (эссенциальные), они организмом человека не вырабатываются, и мы должны в обязательном порядке получать их с пищей.
К заменимым аминокислотам относятся: Аланин, Аргинин, Аспаргин, Аспарагиновая кислота, Глицин, Глутамин, Глутаминовая кислота, Пролин, Серин, Тирозин, Цистин.
Незаменимые аминокислоты: Валин, Изолейцин, Лейцин, Лизин, Метионин, Трионин, Триптофан, Фенилаланин
Для детей незаменимыми аминокислотами являются Аргинин и Гистидин.
По аминокислотам будет отдельный пост.
Классификация белков
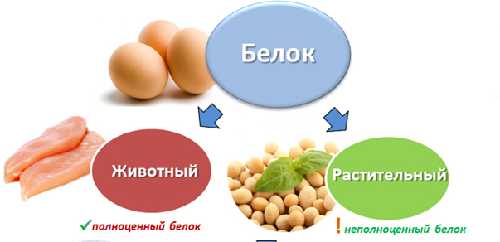
По содержанию аминокислот белки делятся на полноценные и неполноценные.
Полноценный белок содержит в своем составе все необходимые аминокислоты, а неполноценный белок, соответственно, каких-то аминокислот не содержит.
Для строительства всех белков организма важно не только наличие всех аминокислот, но и их пропорции в пищевом продукте. Пища, наиболее близкая по аминокислотному составу белкам тела человека, является оптимальной. Если какой-то одной аминокислоты не хватает, другие аминокислоты не могут использоваться организмом, более того, для того, чтобы возместить нехватку, начнут распадаться собственные белки, в первую очередь белки – ферменты, участвующие в процессах биосинтеза, и мышечные белки. В условиях недостатка той или иной незаменимой аминокислоты, другие аминокислоты оказываются избыточными, хотя этот избыток относительный. Распадающиеся мышечные белки образуют высокотоксичные продукты обмена и усиленно выводятся организмом, создавая отрицательных азотистый баланс. Человек начинает хиреть, хотя может искренне считать, что с питанием у него все в порядке.
По своему происхождению белки делятся на животные и растительные.
К животным белкам относятся белки яиц, молока и молочных продуктов, рыбы и морепродуктов, мясо животных и птиц.
К растительным белкам относятся белки зерновых, бобовых, орехов и грибов.
Продукты питания считаются белковыми, если они содержат не меньше 15% белка.
Все животные белки являются полноценными, т.е. содержат полный набор аминокислот. Большинство растительных белков являются неполноценными.
При недостаточном поступлении белка с пищей в организме развиваются дегенеративные процессы, связанные с невозможностью выполнять необходимые функции. В первую очередь страдает иммунитет. Человек становится предрасположен к вирусным и бактериальным инфекциям, болезни приобретают затяжной, хронический характер. Начинают выпадать волосы, кожа становится дряблой, морщинистой. Страдает волевая сфера, человека охватывает апатия, полное нежелание чем-либо заниматься, присоединяется депрессия. Уменьшается мышечная масса, замедляется обмен веществ. Начинаются проблемы с пищеварением, появляется т.н. «синдром раздраженного кишечника», когда прием пищи сопровождается метеоризмом, поносы сменяются запорами и наоборот. Угнетается детородная функция, у женщин прекращаются месячные. В тяжелых случаях начинаются структурные изменения в органах и тканях, видимое истощение. Белковое голодание детей приводит к умственной отсталости.
Тяжелое белковое голодание в наше время в цивилизованных странах, куда мы относим и нашу страну, если исключить заболевания, типа туберкулеза или онкологии, встречаются у людей, практикующих безумные голодные диеты в маниакальном стремлении похудеть.
Последнее сообщение касалось Анджелины Джоли, ее госпитализировали с весом 35 кг – такими застали советские освободители узников нацистских конц.лагерей. Вряд ли живые скелеты являли собой образцы красоты.
Однако недостаток белка – не такое уж редкое состояние, объясняющееся нездоровой структурой питания, сложившейся вследствие относительной дороговизны белковых продуктов. В стремлении сэкономить люди переходят на углеводно-жировую диету с потреблением неполноценного растительного белка. Свою лепту вносят полуфабрикаты, изготовленные из суррогатов и белковыми продуктами не являющимися. Так человек, покупающий готовые котлеты, колбасу, сосиски может искренне считать, что потребляет достаточно белка. Не заблуждайтесь.
В следующей статье вы узнаете, сколько и какого белка необходимо человеку, чтобы оставаться здоровым.
Оставляйте комментарии, делитесь информацией в социальных сетях. Галина Баева.
zaryad-zhizni.ru
строение и функции. Свойства белков
Как известно, белки — основа зарождения жизни на нашей планете. По теории Опарина-Холдейна именно коацерватная капля, состоящая из молекул пептидов, стала основой зарождения живого. Это и не вызывает сомнений, ведь анализ внутреннего состава любого представителя биомассы показывает, что эти вещества есть во всем: растениях, животных, микроорганизмах, грибах, вирусах. Причем они очень разнообразны и макромолекулярны по природе.
Названий у этих структур четыре, все они являются синонимами:
- белки;
- протеины;
- полипептиды;
- пептиды.
Белковые молекулы
Их количество поистине неисчислимо. При этом все белковые молекулы можно разделить на две большие группы:
- простые — состоят только из аминокислотных последовательностей, соединенных пептидными связями;
- сложные — строение и структура белка характеризуются дополнительными протолитическими (простетическими) группами, называемыми еще кофакторами.
При этом сложные молекулы также имеют свою классификацию.
Градация сложных пептидов
- Гликопротеиды — тесно связанные соединения белка и углевода. В структуру молекулы вплетаются простетические группы мукополисахаридов.
- Липопротеиды — комплексное соединение из белка и липида.
- Металлопротеиды — в качестве простетической группы выступают ионы металлов (железо, марганец, медь и другие).
- Нуклеопротеиды — связь белка и нуклеиновых кислот (ДНК, РНК).
- Фосфопротеиды — конформация протеина и остатка ортофосфорной кислоты.
- Хромопротеиды — очень схожи с металлопротеидами, однако элемент, входящий в состав простетической группы, представляет собой целый окрашенный комплекс (красный — гемоглобин, зеленый — хлорофилл и так далее).
У каждой рассмотренной группы строение и свойства белков различны. Функции, которые они выполняют, также варьируются в зависимости от типа молекулы.
Химическое строение белков
С данной точки зрения протеины — это длинная, массивная цепь аминокислотных остатков, соединяющихся между собой специфическими связями, называемыми пептидными. От боковых структур кислот отходят ответвления — радикалы. Такое строение молекулы было открыто Э. Фишером в начале XXI века.
Позже более подробно были изучены белки, строение и функции белков. Стало ясно, что аминокислот, образующих структуру пептида, всего 20, но они способны комбинироваться самым разным способом. Отсюда и разнообразие полипептидных структур. Кроме того, в процессе жизнедеятельности и выполнения своих функций белки способны претерпевать ряд химических превращений. В результате они меняют структуру, и появляется уже совсем новый тип соединения.
Чтобы разорвать пептидную связь, то есть нарушить белок, строение цепей, нужно подобрать очень жесткие условия (действие высоких температур, кислот или щелочей, катализатора). Это объясняется высокой прочностью ковалентных связей в молекуле, а именно в пептидной группе.
Обнаружение белковой структуры в условиях лаборатории проводится при помощи биуретовой реакции — воздействия на полипептид свежеосажденным гидроксидом меди (II). Комплекс пептидной группы и иона меди дает ярко-фиолетовую окраску.
Существует четыре основные структурные организации, каждая из которых имеет свои особенности строения белков.
Уровни организации: первичная структура
Как уже упоминалось выше, пептид — это последовательность аминокислотных остатков с включениями, коферментами или же без них. Так вот первичной называют такую структуру молекулы, которая является природной, естественной, представляет собой истинно аминокислоты, соединенные пептидными связями, и больше ничего. То есть полипептид линейного строения. При этом особенности строения белков такого плана — в том, что такое сочетание кислот является определяющим для выполнения функций белковой молекулы. Благодаря наличию данных особенностей возможно не только идентифицировать пептид, но и предсказать свойства и роль совершенно нового, еще не открытого. Примеры пептидов, обладающих природным первичным строением, — инсулин, пепсин, химотрипсин и другие.
Вторичная конформация
Строение и свойства белков этой категории несколько меняются. Такая структура может сформироваться изначально от природы либо при воздействии на первичную жестким гидролизом, температурой или иными условиями.
Данная конформация имеет три разновидности:
- Ровные, правильные, стереорегулярные витки, построенные из остатков аминокислот, которые закручиваются вокруг основной оси соединения. Удерживаются вместе только водородными связями, возникающими между кислородом одной пептидной группировки и водородом другой. Причем строение считается правильным из-за того, что витки равномерно повторяются через каждые 4 звена. Такая структура может быть как левозакрученной, так и правозакрученной. Но в большинстве известных белков преобладает правовращающий изомер. Такие конформации принято называть альфа-структурами.
- Состав и строение белков следующего типа отличается от предыдущего тем, что водородные связи образуются не между рядом стоящими по одной стороне молекулы остатками, а между значительно удаленными, причем на достаточно большое расстояние. По этой причине вся структура принимает вид нескольких волнообразных, извитых змейкой полипептидных цепочек. Есть одна особенность, которую должен проявлять белок. Строение аминокислот на ответвлениях должно быть максимально коротким, как у глицина или аланина, например. Этот тип вторичной конформации носит название бета-листов за способность будто слипаться при образовании общей структуры.
- Относящееся к третьему типу строение белка биология обозначает как сложные, разноразбросанные, неупорядоченные фрагменты, не обладающие стереорегулярностью и способные изменять структуру под воздействием внешних условий.
Примеров белков, имеющих вторичную структуру от природы, не выявлено.
Третичное образование
Это достаточно сложная конформация, имеющая название «глобула». Что собой представляет такой белок? Строение его основывается на вторичной структуре, однако добавляются новые типы взаимодействий между атомами группировок, и вся молекула словно сворачивается, ориентируясь, таким образом, на то, чтобы гидрофильные группировки были направлены внутрь глобулы, а гидрофобные — наружу.
Этим объясняется заряд белковой молекулы в коллоидных растворах воды. Какие же типы взаимодействий здесь присутствуют?
- Водородные связи — остаются без изменений между теми же самыми частями, что и во вторичной структуре.
- Гидрофобные (гидрофильные) взаимодействия — возникают при растворении полипептида в воде.
- Ионные притяжения — образуются между разнозаряженными группами аминокислотных остатков (радикалов).
- Ковалентные взаимодействия — способны формироваться между конкретными кислотными участками — молекулами цистеина, вернее, их хвостами.
Таким образом, состав и строение белков, обладающих третичной структурой, можно описать как свернутые в глобулы полипептидные цепи, удерживающие и стабилизирующие свою конформацию за счет разных типов химических взаимодействий. Примеры таких пептидов: фосфоглицераткеназа, тРНК, альфа-кератин, фиброин шелка и другие.
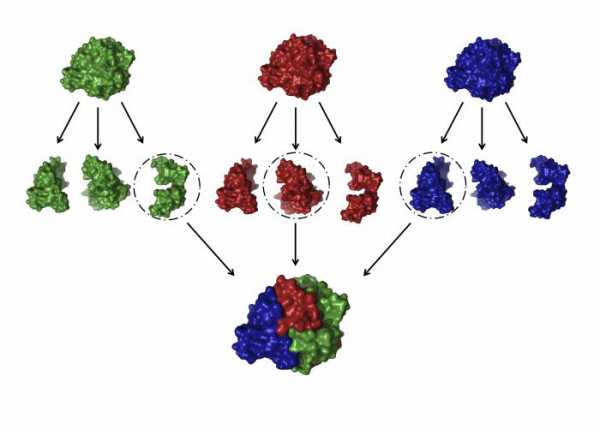
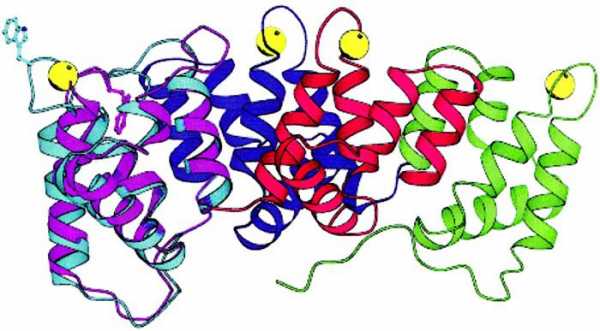
Четвертичная структура
Это одна из самых сложных глобул, которую образуют белки. Строение и функции белков подобного плана очень многогранны и специфичны.
Что собой представляет такая конформация? Это несколько (в некоторых случаях десятки) крупных и мелких полипептидных цепей, которые формируются независимо друг от друга. Но затем за счет тех же взаимодействий, что мы рассматривали для третичной структуры, все эти пептиды скручиваются и переплетаются между собой. Таким образом получаются сложные конформационные глобулы, которые могут содержать и атомы металлов, и липидные группировки, и углеводные. Примеры таких белков: ДНК-полимераза, белковая оболочка табачного вируса, гемоглобин и другие.
Все рассмотренные нами структуры пептидов имеют свои методы идентификации в лабораторных условиях, основанные на современных возможностях использования хроматографии, центрифугирования, электронной и оптической микроскопии и высоких компьютерных технологиях.
Выполняемые функции
Строение и функции белков тесно коррелируют друг с другом. То есть каждый пептид играет определенную роль, уникальную и специфическую. Встречаются и такие, которые способны выполнять в одной живой клетке сразу несколько значительных операций. Однако можно в обобщенном виде выразить основные функции белковых молекул в организмах живых существ:
- Обеспечение движения. Одноклеточные организмы, либо органеллы, или некоторые виды клеток способны к передвижениям, сокращениям, перемещениям. Это обеспечивается белками, входящими в состав структуры их двигательного аппарата: ресничек, жгутиков, цитоплазматической мембраны. Если же говорить о неспособных к перемещениям клетках, то белки могут способствовать их сокращению (миозин мышц).
- Питательная или резервная функция. Представляет собой накопление белковых молекул в яйцеклетках, зародышах и семенах растений для дальнейшего восполнения недостающих питательных веществ. При расщеплении пептиды дают аминокислоты и биологически активные вещества, которые необходимы для нормального развития живых организмов.
- Энергетическая функция. Помимо углеводов, силы организму могут давать и белки. При распаде 1 г пептида высвобождается 17,6 кДж полезной энергии в форме аденозинтрифосфорной кислоты (АТФ), которая расходуется на процессы жизнедеятельности.
- Сигнальная и регуляторная функция. Заключается в осуществлении тщательного контроля за происходящими процессами и передачи сигналов от клеток к тканям, от них к органам, от последних к системам и так далее. Типичным примером может служить инсулин, который строго фиксирует количество глюкозы в крови.
- Рецепторная функция. Осуществляется путем изменения конформации пептида с одной стороны мембраны и вовлечения в реструктуризацию другого конца. При этом и происходит передача сигнала и необходимой информации. Чаще всего такие белки встраиваются в цитоплазматические мембраны клеток и осуществляют строгий контроль над всеми веществами, проходящими через нее. Также оповещают о химических и физических изменениях окружающей среды.
- Транспортная функция пептидов. Ее осуществляют белки-каналы и белки-переносчики. Роль их очевидна — транспортировка необходимых молекул к местам с низкой концентрацией из частей с высокой. Типичным примером служит перенос кислорода и диоксида углерода по органам и тканям белком гемоглобином. Ими же осуществляется доставка соединений с невысокой молекулярной массой через мембрану клетки внутрь.
- Структурная функция. Одна из важнейших из тех, которые выполняет белок. Строение всех клеток, их органелл обеспечивается именно пептидами. Они подобно каркасу задают форму и структуру. Кроме того, они же ее поддерживают и видоизменяют в случае необходимости. Поэтому для роста и развития всем живым организмам необходимы белки в рационе питания. К таким пептидам можно отнести эластин, тубулин, коллаген, актин, кератин и другие.
- Каталитическая функция. Ее выполняют ферменты. Многочисленные и разнообразные, они ускоряют все химические и биохимические реакции в организме. Без их участия обычное яблоко в желудке смогло бы перевариться только за два дня, с большой вероятностью загнив при этом. Под действием каталазы, пероксидазы и других ферментов этот процесс происходит за два часа. В целом именно благодаря такой роли белков осуществляется анаболизм и катаболизм, то есть пластический и энергетический обмен.
Защитная роль
Существует несколько типов угроз, от которых белки призваны оберегать организм.
Во-первых, химическая атака травмирующих реагентов, газов, молекул, веществ различного спектра действия. Пептиды способны вступать с ними в химическое взаимодействие, переводя в безобидную форму или же просто нейтрализуя.
Во-вторых, физическая угроза со стороны ран — если белок фибриноген вовремя не трансформируется в фибрин на месте травмы, то кровь не свернется, а значит, закупорка не произойдет. Затем, наоборот, понадобится пептид плазмин, способный сгусток рассосать и восстановить проходимость сосуда.
В-третьих, угроза иммунитету. Строение и значение белков, формирующих иммунную защиту, крайне важны. Антитела, иммуноглобулины, интерфероны — все это важные и значимые элементы лимфатической и иммунной системы человека. Любая чужеродная частица, вредоносная молекула, отмершая часть клетки или целая структура подвергается немедленному исследованию со стороны пептидного соединения. Именно поэтому человек может самостоятельно, без помощи лекарственных средств, ежедневно защищать себя от инфекций и несложных вирусов.
Физические свойства
Строение белка клетки весьма специфично и зависит от выполняемой функции. А вот физические свойства всех пептидов схожи и сводятся к следующим характеристикам.
- Вес молекулы — до 1000000 Дальтон.
- В водном растворе формируют коллоидные системы. Там структура приобретает заряд, способный варьироваться в зависимости от кислотности среды.
- При воздействии жестких условий (облучение, кислота или щелочь, температура и так далее) способны переходить на другие уровни конформаций, то есть денатурировать. Данный процесс в 90% случаев необратим. Однако существует и обратный сдвиг — ренатурация.
Это основные свойства физической характеристики пептидов.
fb.ru
Белки и их функции. | steelbros.ru
Белки и их функции.Изучим основные вещества составляющие наши с вами организмы. Одни из них самых важных это белки.
Белки ( протеины, полипептиды ) – углеродные вещества, состоящие из соединенных в цепочку аминокислот. Являются обязательной составной частью всех клеток.
Аминокислоты — углеродные соединения,, в молекулах которых одновременно содержатся карбоксильные ( -COOH ) и аминные ( Nh3 ) группы.
Соединение, состоящее из большого числа аминокислот, называется — полипептидом. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300-500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3-8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот.
Свойства белков, определяет их аминокислотный состав, в строго зафиксированной последовательности, а аминокислотный состав в свою очередь определяется генетическим кодом. При создании белков используется 20 стандартных аминокислот.
Структура белков.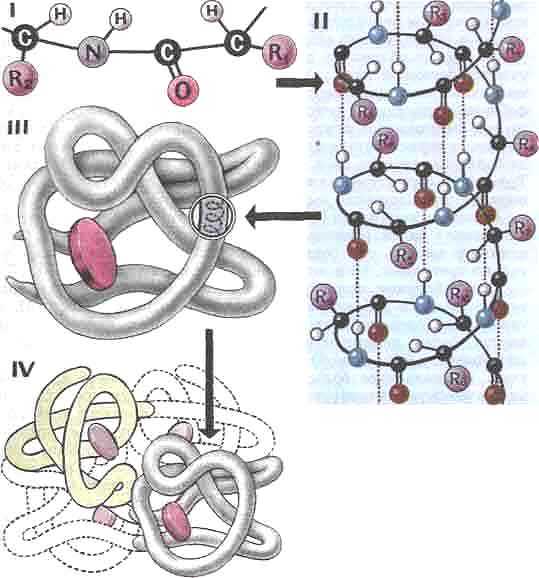
Выделяют несколько уровней:
— Первичная структура — определяется порядком чередования аминокислот в полипептидной цепи.
Двадцать разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены «слова» длиной в 300-500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Если считать, что замена или перестановка хотя бы одной буквы в слове придает ему новый смысл, то число комбинаций в слове длиной в 500 букв составит 20500.
Известно, что замена даже одного аминокислотного звена другим в белковой молекуле изменяет ее свойства. В каждой клетке содержится несколько тысяч разных видов белковых молекул, и для каждого из них характерна строго определенная последовательность аминокислот. Именно порядок чередования аминокислот в данной белковой молекуле определяет ее особые физико-химические и биологические свойства. Исследователи умеют расшифровывать последовательность аминокислот в длинных белковых молекулах и синтезировать такие молекулы.
— Вторичная структура – белковые молекулы в виде спирали, с одинаковыми расстояниями между витками.
Между группами N-Н и С=О, расположенными на соседних витках, возникают водородные связи. Они повторенные многократно, скрепляют регулярные витки спирали.
— Третичная структура – образование спиралиевого клубка.
Этот клубок образован закономерным переплетением участков белковой цепи. Положительно и отрицательно заряженные группы аминокислот притягиваются и сближают даже далеко отстоящие друг от друга участки белковой цепи. Сближаются и иные участки белковой молекулы, несущие, например, «водоотталкивающие» (гидрофобные) радикалы.
Для каждого вида белка характерна своя форма клубка с изгибами и петлями. Третичная структура зависит от первичной структуры, т. е. от порядка расположения аминокислот в цепи.
— Четвертичная структура – сборный белок, состоящий из нескольких цепей, отличающихся по первичной структуре.
Объединяясь вместе, они создают сложный белок, обладающий не только третичной, но и четвертичной структурой.
Денатурация белка.
Под действием ионизирующей радиации, высокой температуры, сильного взбалтывания, экстремальных значений рН ( концентрация йонов водорода ), а также ряда органических растворителей, таких, как спирт или ацетон, белки изменяют свое естественное состояние. Нарушение природной структуры белка называют денатурацией. Подавляющее большинство белков утрачивает при этом биологическую активность, хотя первичная структура их после денатурации не меняется. Дело в том, что в процессе денатурации нарушаются вторичная, третичная и четвертичная структуры, обусловленные слабыми взаимодействиями между аминокислотными остатками, а ковалентные пептидные связи ( с объединением электронов) не разрываются. Необратимую денатурацию можно наблюдать при нагревании жидкого и прозрачного белка куриного яйца: он становится плотным и непрозрачным. Денатурация может быть и обратимой. После устранения денатурирующего фактора многие белки способны вернуть естественную форму, т.е. ренатурировать.

Способность белков к обратимому изменению пространственной структуры в ответ на действие физических или химических факторов лежит в основе раздражимости — важнейшего свойства всех живых существ.
Функции белков.
Каталитическая.
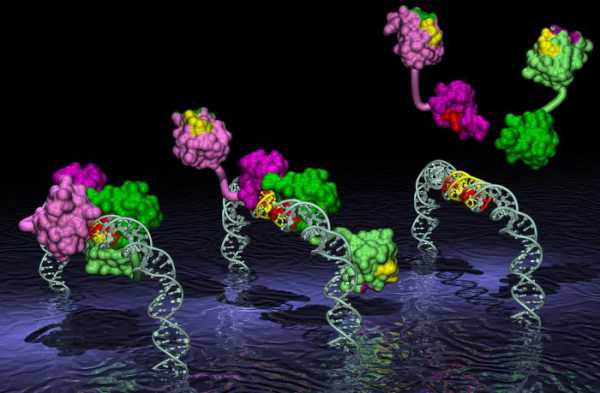
В каждой живой клетке происходят непрерывно сотни биохимических реакций. В ходе этих реакций идут расщепление и окисление поступающих извне питательных веществ. Полученную вследствие окисления энергию питательных веществ и продукты их расщепления клетка использует для синтеза необходимых ей разнообразных органических соединений. Быстрое протекание таких реакций обеспечивают биологические катализаторы, или ускорители реакций, — ферменты. Известно более тысячи разных ферментов. Все они белки.
Белки-ферменты – ускоряют протекающие реакции в организме. Ферменты учавствуют в расщеплении сложных молекул ( катаболизм ) и их синтезе ( анаболизм ) а также создания и ремонте ДНК и матричного синтеза РНК.
Структурная.
Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
Защитная.
- Физическая защита. (пример : коллаген — белок, образующий основу межклеточного вещества соединительных тканей )
- Химическая защита. Связывание токсинов белковыми молекулами обеспечивает их детоксикацию. (пример: ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма)
- Иммунная защита. На попадание бактерий или вирусов в кровь животных и человека организм реагирует выработкой специальных защитных белков — антител. Эти белки связываются с чужеродными для организма белками возбудителей заболеваний, чем подавляется их жизнедеятельность. На каждый чужеродный белок организм вырабатывает специальные «антибелки» — антитела.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и программируемую клеточную смерть, обеспечивают согласованность действий иммунной, эндокринной и нервной систем.
Транспортная.
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны— Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки).
Рецепторная.
Белковые рецепторы могут как находиться в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы.
Строительная.
Животные в процессе эволюции утратили способность осуществлять синтез десяти особенно сложных аминокислот, называемых незаменимыми. Они получают их в готовом виде с растительной и животной пищей. Такие аминокислоты содержатся в белках молочных продуктов (молоко, сыр, творог), в яйцах, рыбе, мясе, а также в сое, бобах и некоторых других растениях. В пищеварительном тракте белки расщепляются до аминокислот, которые всасываются в кровь и попадают в клетки. В клетках из готовых аминокислот строятся собственные белки, характерные для данного организма. Белки являются обязательным компонентом всех клеточных структур и в этом состоит их важная строительная роль.
Энергетическая.
Белки могут служить источником энергии для клетки. При недостатке углеводов или жиров окисляются молекулы аминокислот. Освободившаяся при этом энергия используется на поддержание процессов жизнедеятельности организма. При длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Моторная (двигательная).
Целый класс моторных белков обеспечивает движения организма, например, сокращение мышц, в том числе движение миозиновых мостиков в мышце, перемещение клеток внутри организма (например, амебоидное движение лейкоцитов).
На самом деле это очень краткое описание функций белков, которое только наглядно может продемонстрировать их функции и значимость в организме.
Немного видео для понимания о белках:
steelbros.ru