Спирты и органические кислоты
Спирты и органические кислоты — это органические соединения (углеродные соединения, производимые живыми организмами). Вино и пиво содержат этиловый спирт (этанол), но существует много других спиртов, которые в промышленности используются как растворители (жидкости, растворяющие другие вещества). Органические кислоты имеют свойства, характерные для кислот вообще: они окрашивают лакмус в красный цвет и при взаимодействии со щелочами образуют соли. Мыло — это соль, полученная при взаимодействии органической кислоты со щелочью — гидроксидом натрия.
Спирты
Спирты — органические соединения, содержащие углерод, водород и кислород. Спирты составляют гомологический ряд, т.е. группу соединений со сходными химическими свойствами. Кислород и водород образуют гидроксильную группу, которая определяет специфические свойства спиртов. Этиловый спирт (этанол) получают путем брожения или через реакцию этилена (см. статью «Органическая химия») с водяным паром (С2
Брожение
Брожение — химическая реакция, которую люди на протяжении тысячелетий используют для изготовления алкогольных напитков. И ныне брожение играет важную роль в производстве этанола. При брожении ферменты дрожжевого грибка (катализаторы, ускоряющие реакции в живых организмах) превращают глюкозу фруктов или зерен в этанол. При брожении сахара в виноградном соке получается вино; сидр делают из яблок, а виски — из злаков.
Органические кислоты
Уксусная кислота, придающая уксусу кислый вкус, и муравьиная кислота, жгучая жидкость муравьев, — это органические кислоты. Они относятся к группе карбоновых кислот. Другие представители этой группы — жирные кислоты — содержатся в животных жирах и растительных маслах. Кокосовое масло содержит жирные кислоты. Органические кислоты образуются при окислении спиртов, т.е. при добавлении к ним кислорода, сколько тысяч лет назад люди уже знали, что вино, содержащее этиловый спирт, при окислении превращается в уксус. Уксусная кислота используется в производстве полиэфирных синтетических волокон. В составе уксуса она используется для консервации продуктов. При реакции карбоновой кислоты со спиртом образуются так называемые сложные эфиры и вода. Эфиры придают цветам и плодам запах. Жиры и масла — это эфиры, состоящие из глицерина или гликоля (это спирты) и жирных кислот. Запахи, привлекающие насекомых к цветам, — это эфиры, соединения жирных кислот и спиртов.
Мыло и моющие средства
Моющее средство помогает воде смывать грязь. Мыло — одно из моющих средств. Есть моющие средства, не содержащие мыла. Моющие средства ослабляют притяжение между молекулами воды, и вода легче растекается по поверхности. Мыло делают из растительных масел, содержащих жирные кислоты. При нагревании масел в присутствии щелочи — гидроксида натрия — кислоты вступают в реакции со щелочью и образуют соли — мыло.
Молекулы мыла содержат ионы, расположенные па конце длинной молекулы. Заряженная сторона молекулы притягивается к воде, «хвост» — к жиру. Хвосты соединяются с частицами жира и образуют «мост» между водой и жиром. Благодаря связи с водой они способствуют отделению жира от поверхности. Не содержащие мыла моющие средства действуют таким же образом, и они не подвержены воздействию минералов в жесткой воде, в которой обычное мыло образует хлопья. Но они содержат фосфаты, способствующие избыточному росту растений в прудах и реках.
www.polnaja-jenciklopedija.ru
Спирты отношение к щелочи — Справочник химика 21
Полимеры простых виниловых эфиров могут быть разнообразной консистенции—-от жидкостей до твердых или каучукообразных продуктов. Это зависит от структуры и молекулярного веса полимеров. Жидкие полимеры обладают адгезионными свойствами (стойки в отношении щелочей). Полимеры простых эфиров винилового спирта растворимы в большинстве органических растворителей, но некоторые не растворимы в этиловом спирте. Метиловый эфир поливинилового спирта растворим в холодной воде, но выделяется из водного раствора при нагревании. Простые эфиры поливинилового спирта и многоатомных спиртов представляют собой хрупкие, неплавкие и нерастворимые продукты. Они толь-В качестве основной методики окисления бы.па принята методика Бона с сотрудниками. Отношение щелочи к углю составляло 1,6 и отношение перманганата к углю—10,4, в расчете на сухой, беззольный уголь. Цифры, пересчитанные на беззольный уголь, показывают, что общее количество сухих, неочищенных кислот, выделенных при окислении, составляло 67,0 г на 100 г угля. При превращении этих кислот в сложные эфиры было получено 56,7 г метиловых эфиров. Пос,т1е разбавления этих соединени этиловым спиртом с последующим выдерживанием в течение нескольких недель было выделено 5,12 г кристал.лических эфиров. Все полученные эфиры были разогнаны в высоком вакууме с разделением на 23,5 г дестиллата в десяти фракциях при температурах, не
Фторопласт-4 обладает способностью работать без смазки, с низким коэффициентом трения, составляющим при скольжении по чугуну и стали 0,09—0,10, причем с повышением удельного давления до 15—30 Мн1м коэффициент трения снижается до 0,04. Он сохраняет удовлетворительные механические свойства в широком диапазоне температур от —215 до +260° С, имеет температуру спекания 375—390° С, разлагается при 400° С, совершенно не гидроскопичен и химически стоек по отношению почти ко всем химически активным веществам — щелочам, кислотам, спиртам, эфирам и маслам. [c.647]
Кубовый темно-синий О. Это темно-фиолетовый порошок, нерастворимый в воде и слабых кислотах, но растворимый в спирте и щелочах. Накраски этим красителем прочны во всех отношениях. Этот краситель, так же как кубовый синий, приобретает технические свойства в качестве пигмента при переосаждении из серной кислоты или из щелочного раствора.
Виолантрон выпускают под названием кубовый темносиний О. Он представляет собою темнофиолетовый порошок, нерастворимый в воде и слабых кислотах, но растворимый в спирте и щелочах. Окраски этим красителем прочны во всех отношениях. [c.536]
ОПЫТЫ С АМИЛОВЫМ СПИРТОМ Отношение спирта к щелочи [c.115]
Денатурирующими агентами могут быть различные химические факторы кислоты и щелочи, изменяющие реакцию среды белковых растворов, выходящую за пределы значения pH от 3 до 10, т. е. лежащего вне зоны устойчивости белковых молекул разные легко гидратирующиеся соли, которые могут не только высаливать белки, по и денатурировать их в этом отношении остается справедливым лиотропный ряд для анионов Гофмейстера, в котором роданид и близлежащие к нему анионы вызывают денатурацию, в противоположность сульфатному концу ряда органические растворители, например ацетон, этиловый и метиловый спирты и др., снимающие водную оболочку у белков соответствующие окислители, производящие разрыв дисульфидных мостиков в белковой молекуле гуанидин и карбамид (мочевина), изменяющие количество водородных связей и, следовательно, конфигурацию белка (как бы производят плавление его комплексной спиральной структуры) и др.
Примечание. Параллельно рекомендуется демонстрировать отношение спиртов к щелочи (стр. 115). [c.334]
Некоторое сходство в свойствах спиртов и щелочей действительно наблюдается (отношение к кислотам). Если от двух частиц щелочи (например, едкого кали) отнять частицу воды, получится ангидридное соединение — окись калия [c.188]
Химическая стойкость найлона не очень высока. Так, он относительно мало стоек по отношению к многим минеральным кислотам и сильным окислителям, но инертен к щелочам, жирным и ароматическим углеводородам, спиртам, кетонам и сероуглероду. При кипячении с 5% раствором H i он становится хрупким и затем рассыпается.
Если для исследования взят полимер, то его растворяют в растворителях, инертных по отношению к НС1 (спирт, диоксан). Перед добавлением реактива раствор формальдегида нейтрализуют 0,5 и. растворами кислоты и щелочи. Индикатором служит 1%-ный раствор бромфенола голубого в. спирте. Пробу альдегида отмеряют градуированной пипеткой с достаточно широким отверстием, чтобы ее можно было использовать для вязких смоляных растворов. [c.22]
Фенолы — довольно кислые соединения и в этом отношении они заметно отличаются от спиртов, которые представляют собой даже более слабые кислоты, чем вода. Действием водных растворов щелочей фенолы превращаются в соли водные минеральные кислоты превращают соли обратно в свободные фенолы. Как и следовало ожидать, фенолы и их соли противоположны по своей растворимости соли растворимы в воде и нерастворимы в органических растворителях.
Полистирол — твердый, хрупкий, прозрачный как стекло или мутноватый материал, устойчивый до 70 С (некоторые сорта — до 100°С). Он инертен по отношению к кислотам, щелочам, спиртам, маслам и жирам, но разрушается конц. НЫОз, бензином, бензолом, простыми и сложными эфирами, кетонами и хлорированными углеводородами. Сополимеры стирола с бутадиеном или с акрилонитрилом менее хрупки.
Приготовленные указанными способами ультрафильтры могут быть использованы и для фильтрования растворов в некоторых органических растворителях. Для этого воду из фильтра вытесняют спиртом, а затем бензолом или другим подходящим растворителем. Следует помнить, что фильтрами из нитроцеллюлозы нельзя пользоваться для фильтрования растворов в эфире, ацетоне, ледяной уксусной кислоте, уксусноэтиловом эфире, так как эти растворители растворяют нитроцеллюлозу или вызывают ее набухание. Нитроцеллюлозные фильтры устойчивы по отношению к кислотам, разбавленным щелочам, а также к бензолу, толуолу, четыреххлористому углероду, хлороформу, сероуглероду. [c.80]
Наиболее важными в промышленном отношении путями переработки высокомолекулярных парафиновых сульфохлоридов до сих пор являются омыление щелочами с образованием растворимых в воде солей сульфокислот, обладающих прекрасными смачивающими, моющими и эмульгирующими свойствами далее получение эфиров при взаимодействии фенолов с алифатическими спиртами с образованием лрильных или алкильных эфиров сульфокислот, являющихся очень хо- [c.407]
Очистка от карбонилхлорид а. Содержащийся в виде примеси карбонилхлорид медленно реагирует с водой, спиртами и щелочами и быстро реагирует с фенолятом натрия даже при небольших концентрациях. Гилло [706] показал, что хлороформ трудно очищать ввиду его нестабильности и чувствительности по отношению к свету и действию кислорода. Он нашел, что содержание карбонилхлорида всегда превосходит 0,0003%. [c.390]
Как мы уже знаем, лз спиртов и щелочей образуются алкоголяты, основность которых вйсока. Такие смеси, обладающие одновременно высокой основностью и хорошей сольватирующей способностью, пригодны для дегазации даже таких ОВ, которые в водных средах очень устойчивы к нуклеофильным атакам. При рассмотрении процессов, происходящих при дегазации различных ОВ этими дегазирующими жидкостями, возникает вопрос о том, как влияет полярность растворителей на скорость нуклеофильного замещения. С возрастанием полярности растворителей возрастает их склонность к образованию водородных связей если ОВ обладает высокой полярностью, то скорость реакции уменьшается. С такими отношениями столкнулись при дегазации У-газов [c.316]
Скорость подачи окиси этилепа, мг1сек Отношение щелочь спирт Темпера- тура реакции, °С Процент непрореагировавшей окиси этилена через [c.206]
Взаимоотношения микроорганизмов друг с другом. Следует отметить, что в природе микроорганизмы, как правило, находятся не в оптимальных условиях ресурсы поступают медленно) и растут приблизительно на 1 % от своих возможностей. С другой стороны, микроорганизмы взаимодействуют между собой. В некоторых случаях складываются конкурентные взаимоотношения, и тогда микроорганизмы стюсобны вырабатывать вещества для подавления конкурентной микробиоты (особенно в почвах) — антибиотики, токсины или менее специфичные и неспецифичные вещества (спирты, кислоты, щелочи и т.д.). Реже в природе встречаются отношения кооперации между микроорганизмами. Обычно большинство аэробных микроорганизмов могут расщеплять субстрат самостоятельно. Факультативная кооперация может возникать в случае накопления какого-нибудь продукта. В анаэробных условиях кооперация более облигатна. В таком сообществе микроорганизмов возникают прочные трофические связи и часто субстрат может быть расщеплен до простых веществ именно группой микроорганизмов, а не отдельными ее членами, которые в виде чистых культур [c.266]
Создание новых процессов, базирующихся на более доступном или дешевом сырье, обычно является результатом от-кр1ития новых реакций и нередко оказывает революционизирующее влияние на развитие технологии. В отношении ископаемого сырья — это уже отмеченное выше перебазирование органического синтеза с каменного угля на нефть и газ. Постепенное исчерпание месторождений нефти и газа рано или поздно должно привести к возвращению на твердое топливо, что серьезно скажется на всей структуре технологии, В отношении пяти главных групп исходных веществ для органического сннтеза выявилась тенденция замены дорогостоящего ацетилена па низшие олефины и даже парафины, а а чкже усилоииое развитие синтезов на основе СО и Нг, которые могут базироваться иа угле. В других случаях разрабатываются ноЕые процессы с заменой сырья сии )тов на олефины, фосгена на ди( ксид углерода, дорогостоящих окислителей (хромпик, пероксид водорода, азотная кислота) на кислород и воздух, различных восстановителей на водород и т. д. К этому же вопросу относится ра .работка прямых методов синтеза, исключающих расход кислот илн щелочей, например прямая гидратация олефинов вместо сернокислотной при синтезе спиртов и т. д. [c.18]
Смесь газообразного парафинового углеводорода с кислородом и НВг, обычно в отношении 2 2 1, реагирует в паровой фазе при 180—200° в течение примерно 3 минут. Присутствие НВг уменьшает тенденцию к горению и крекингу углеродного скелета. Этан в этих условиях дает уксусную кислоту, пропанацетон ц некоторое количество пропионовой кислоты, н-бутан дает метилэтилкетон, диацетил и изобутан соответственно — гидроперекись третичного бутила и третичный бутиловый спирт. Выход кислородсодержащих продуктов — 50—80% на прореагировавший углеводород. После образования кетонов НВг немедленно удаляют из газов поглощением щелочью или олефинами. [c.465]
Эфиры представляют собой очень устойчивые соединения и в этом отношении превосходят спирты. Они не вступают в реакцию со щелочными металлами (металлический натрий применяют даже для сушки эфира), весьма устойчивы к действию щелочей, но легко расщепляются кислотами. Для этой цели особенно часто применяют галоидоводородные кислоты, в том числе наиболее сильно действующую иодистоводо-родную кислоту. Последняя на холоду расщепляет эфир на иодистый алкил и спирт [c.150]
Свойства фенолов. 1. Фенолы имеют большую кислотность, чем спирты, уступая, однако, в этом отношении карбоновым кислотам. Они растворяются в водных растворах щелочей, причем их соли, феноляты, лишь слабо гидролизуются водой. Двуокись углерода осаждает 41Снолы из водных щелочных растворов, и таким способом они могут быть отделены от карбоновых кислот. Следовательно, ароматический остаток усиливает кислотные свойства гидроксилыюй группы. Это вызывается, по-видимому, той же причинои, которая обусловливает сильно кислотный характер енолов. Более же сильную кислотность енолов по сравнению с насыщенными спиртами мы объясняли тем, что в этих соединениях гидроксильная группа находится у двойной связи в фенолах гидроксильная группа также связана с ненасыщенным атомом углерода (по формуле бензола Кекуле она находится у двойной связи ). [c.538]
При восстановлении натрием и спиртом 2,5-дикетопиперазины образуют, правда с незначительным выходом, пиперазины. Эта реакция имеет значение для установления их строения. По отношению к щелочам дикетопиперазины, особеино простейшие, очень чувствительны присоединяя воду, они расщепляются до дипептидов. Кислоты гидролизуют обыкновенные 2,5-дикетопиперазины и их Ы,Ы -диалкнльные производные. пишь прн д. ттельно.м кипячении. Совершенно иначе ведет себя производное десмотропной формы — 0,0 -дибензилдиоксидигидропир-азик (ср. выше) он распадается на бензиловый спирт и 1 ликоколь уже при действии очень разбавленных кислот на холоду. [c.1037]
Сравните свойства этилового спирта и этилмер-каптана 1) отношение к окислителям, 2) растворимость в воде, 3) отношение к действию водного раствора щелочи. [c.57]
Замещение галоида водородом при помощи омедненного цинка и восстановление амальгамой цинка будут. рассмотрены ниже. Большое значение имеет восстановление нитросоединений цинком , в щелочном растворе, так как при этом невозможны никакие побочные акции. Практически этот способ применяют прежде всего для получения гидразосоединений, из которых путем окисления можно получить азосоединения легче, чем методом непосредственного восстановления нитросоединений. Реакцию ведут при температуре кипения. Нитросоединения растворяют в растворе едких щелочей, иногда с добавлением некоторого количества спирта. К раствору при энергичном перемешивании дббавляют цинковую пыль с такой скоростью, чтобы кипение не было слишком бурным. Количество употребляемого цинка устанавливают в зависимости от природы восстанавливаемого продукта. В среднем применяют 30%-ный избыток цинка по отношению к теоретически необходимому. Выход и продолжительность реакции в большой степени зависят от чистоты цинковой пыли. Перед восстановлением цинковую пыль анализируют следующим образом. К 0,2 г цинковой пыли добавляют 125 мл 0,1 н. раствора бнхро-мата калия я Ь мл 20%-ной серной кислоты. Смесь встряхивают.до полного растворения цинка и разбавляют водой до 500 мл. К 100 мл этого раствора добавляют 2 г иодистого калия и 20 мл 20%-ной серной кислоты оставляют на 0,5 часа и титруют 0,1 н. раствором тиосульфата натрия. Цинковую пыль с содержанием менее 75% чистого цинка нельзя применять для восстановления во многих случаях требуется еще более чистый цинк. Эти реакции очень легко контролировать в связи с тем, что промежуточно образующиеся азосоединения окрашены при обесцвечивании раствора реакцию следует прервать, чтобы избежать дальнейшего восстановления до амина. К реакционной смеси добавляют спирт для растворения частично выделившегося гидразосоединения и фильтруют горячим для отделения от избытка цинковой пыли, добавляя к фильтрату. 32—774 [c.497]
Феноксиметилпенициллин — белый кристаллический порошок без запаха, кисловато-горького вкуса, негигроскопичен, т. пл. 118—120°, [а о = + 180—200° (с = 1,95 -ный спирт), мало растворим в воде, растворяется в метиловом и этиловом спиртах, ацетоне, хлорослабокислой среде, но разлагается при кипячении со щелочами и в присутствии фермента пенициллиназы. К солнечному свету устойчив. При взаимодействин с растворами хлоргидрата гидроксиламина, едкого натра, а затем уксусной кислоты, а также нитрата меди выделяется зеленый осадок. Для определения удельного поглощения по ГФ1Х 0,09— 0,1 гпрепарата (точную навеску) растворяют в 4 5″о-ного раствора гидрокарбоната натрия, разбавляют водой до 500 мл и определяют оптическую плотность (D) ири длине волны 268 ммк и при 274 ммк в кювете с толщиной слоя 1 см. Контрольным раствором служат 4 л1/г5 о-ного раствора гидрокарбоната натрня, разведенные водой до 500 мл. Прп длине волны 268 чмк Е = 34,8. Отношение D при длине волны 268 ммк к D при длине волны 274 ммк должно быть не менее 1,21 и не более 1,24. [c.735]
Свойства Диэтилмалонилмочевина образует бесцветные кристаллические ли точки слабо-горьк го виуса. Они плавятся при 191° и растворяются в воде, дтвая кислую реакцию. Взронал легко растворим в спирте, эфире и разбавленной натровой щелочи. В воде он растворяется в следующих отношениях при 15°—1 170, при 100° —1 17. [c.168]
Реакции Курциуса и Шмидта можно проводить с реагентами и растворителями, совершенно не содержащими гидроксильных групп в случае реакции Щмидта для этой цели в качестве катализатора пользуются хлорным оловом вместо обычно применяющейся серной кислоты. Все три реакции необходимо вести при полном отсутствии влаги, но только при реакциях Курциуса и Гофмана можно применять в качестве растворителя абсолютный спирт. Так как реакция Курциуса успешно протекает в среде от нейтральной до сильно кислой, то, пользуясь ею, мож1Ю расщеплять соединения, не подвергая их действию крепких кислот или щелочей. При проведении -реакции Гофмана трудно избежать некоторого соприкосновения с крепкой щелочью, а при реакции Шмидта все пригодные катализаторы являются сильными кислотами (в том смысле, в каком этот термин понимается по теории Льюиса) и действуют каталитически в отношении многих других реакций. [c.344]
Со спиртами и фенолами П. образует простые эфиры гликолей в присут. щелочей-преим. первичный эфир, в присут. к-т-смесь первичного и вторичного эфиров в рамиом отношении [c.105]
Синтез Вильямсона представляет нуклеофильное замещение иона галогена алкоголят- или фенолят-ионом он аналогичен синтезу спиртов из алкилгалогенидов при действии водного раствора щелочи (разд. 15.10). Арилгалогениды нельзя использовать вследствие их низкой реакционной способности по отношению к нуклеофильному замещению, если в кольце не присутствуют ЫОа-группы (или другие сильные электроноакцепторные группы)-в орто- или nupu-положении к галогену (разд. 26.10). [c.537]
Когда шлифы или краны приходят в соприкосновение с органическими растворителями, описанные выше смазочные вещества неприменимы. В этом с. учае вместо обычных шлифов используют прецизионные прозрачные шлифы с оплавленной поверхностью. Такого же типа краны применяют без смазки, заменяя ее специальными тефлоновыми прокладками. Такой кран не пропускает жидкости, но не является вакуумно-плотным. В особых случаях (например, для работы при высоких температурах) соединения на шлифах уплотняют при помощи пленок из полиэтилена или кель-f. При этом пленку вставляют между предварительно нагретыми частями шлифа. Если шлифы были нагреты достаточно сильно, пленка при сжатии плавится и растекается, давая прозрачное соединение, которое при охлаждении затвердевает, а при нагревании снова разжижается (т. пл. пленки из полиэтилена 90—120 °С, пленки из кель-f — 200—230 °С). Следует указать, что при слишком сильном охлаждении пленка из кель-f становится настолько твердой, что не обеспечивает надежного уплотнения тогда используют пасту на основе кель-f. Особенно устойчивы к действию органических растворителей, соединений фтора, а также к изменению температуры манжеты, изготовленные из тефлона, которые, однако, не дают вакуумно-плотного соединения. Тефлон выпускается и в виде эмульсии, твердеющей после ее нанесения. В противоположность кель-f тефлон не термопластичен, но благодаря своему низкому коэффициенту трения обладает самосмазывающими свойствами . Пленки из кель-А при 25 °С инертны по отношению к кислотам, щелочам, окислителям, этанолу и в различной степени также к другим растворителям. Тефлон устойчив при температурах от —200 до — -260°С к спиртам, высшим эфирам, кетонам, анилину, бензолу, галогенам, трифториду бора, галогеноводородам, щелочам, кислотам, хлориду сульфинила и др. [c.47]
Восстановительное действие метилата натрия на нитробензол обнаружено давно ). Работа с этиловым спиртом требует не менее, если не более, осторожности в этом отношении. Поэтому здесь внимание ведущих процесс должно быть направлено на устранение побочных реакций, в которых участвует нитрогруппа исходного материала, и доведение до минимума возможного гидролиза хлорнитрозамещенного от действия щелочи и воды, образующейся при реакции [c.221]
chem21.info
Спирты — номенклатура, получение, химические свойства » HimEge.ru
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
Классификация спиртов
По числу гидроксильных групп (атомности) спирты делятся на:
Одноатомные, например:
Двухатомные (гликоли), например:
Трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
Например:
Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)
Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:
Давайте дадим название спирту, формула которого указана ниже:
Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов-метанол,имея относительную молекулярную массу 32, в обычных условиях-жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C12H25OH) при комнатной температуре-твердые вещества. Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
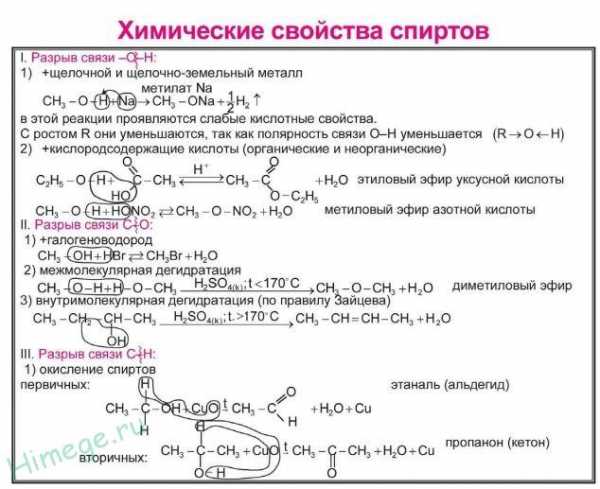
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима. - Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир. - Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)
Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
- Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. - Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
- Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
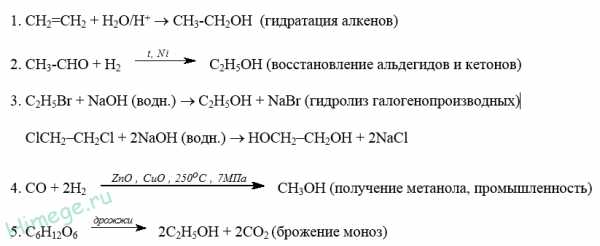
Получение спиртов:
Применение спиртов
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
himege.ru
если к спирту добавить спиртовой р-р щелочи что будет?
ничего не будет: будет спиртовый раствор только более низкой концентрации
нет. спирты не взаимодействуют со щелочами. взаимодействуют только с металами. если бы был галогенпроизводный вместо спирта, то реакция пошла и произошло бы образование двойной связи.
Реакция спиртов со щелочами обратима, т. к. образующаяся вода гидролизует алкоголят, и равновесие сильно смещено влево. При действии на спирты водных щелочей алкоголяты практически не образуются. Алкоголяты — твердые вещества, обычно хорошо растворимые в соответствующем спирте. Они подобны солям очень слабых кислот и нацело гидролизуются при действии воды с образованием спирта и щелочи.
touch.otvet.mail.ru
2.5.1.1. Кислотные свойства гидроксисоединений
2.5.1.1. Кислотные свойства гидроксисоединений 2.5.1.1. Кислотные свойства гидроксисоединенийОдноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли алкоголяты (алкоксиды):
2C2H5OH + 2K 2C2H5OK+ + H2
Видеоопыт «Взаимодействие спиртов с металлическим натрием».
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
Спирты более слабые кислоты, чем вода, т.к. алкильный радикал, проявляя +I-эффект, повышает электронную плотность на атоме кислорода и уменьшает полярность связи ОН. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
(равновесие этой реакции сдвинуто влево,
т.к. соли спиртов в воде гидролизуются)
Кроме того, спирты способны вытеснять углеводороды, которые можно рассматривать как еще более слабые кислоты, из их солей (например, из реактивов Гриньяра RMgHal):
ROH + R’MgBr R’H + Mg(OR)Br Кислотность одноатомных спиртов убывает в ряду:CH3OH > первичный > вторичный > третичныйМногоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов:
2HOCH2CH2OH + 4Na 2NaOСH2CH2ONa + 2H2HOCH2CH2OH + 2NaOH NaOCH2CH2ONa + 2H2O
Видеоопыт «Взаимодействие глицерина с металлическим натрием».
Такие спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)». Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).Фенолы являются более сильными кислотами, чем спирты и вода,
т.к. за счет участи¤ неподеленной электронной пары кислорода в сопряжении с
π-электронной системой бензольного кольца полярность связи
ОН увеличивается.
Фенолы реагируют не только с металлическим натрием, но и с гидроксидами щелочных и щелочноземельных металлов, образуя соли феноляты:
Видеоопыт «Взаимодействие фенола с металлическим натрием».
Видеоопыт «Взаимодействие фенола с гидроксидом натрия».
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реация на фенол».
orgchem.ru
Кислотный спирт — Большая Энциклопедия Нефти и Газа, статья, страница 1
Кислотный спирт
Cтраница 1
Кислотный спирт — кислота, в данном случае азотная. [1]
Главные кислотные спирты, которые производятся особенно минеральными и растительными телами, такие: серный спирт 16, купоросные спирт 17 и масло, спирты квасцов, селитры, поваренной соли 18, уксус. Каждый из иих содержит в себе воду, даже если рассматривать самые ректификованные спирты: все они, соединяясь с самыми сухими щелочными солями, выделяют три перегонке безвкусную влату. Затем все вообще сходны по разъедающей способности и кислому вкусу, но различаются их силою и другими свойствами. Следовательно, при прочих равных условиях, каждый в отдельности должен был бы обладать одинаковой силою. Так как, однако, этого на деле нет, то достаточная причина заключена вне этого начала в инородных началах; последние притупляют силу кислоты, будучи примешаны в разных количествах к кислотному началу. Отсюда вытекает следствие: чем более притуплены разъедающая сила и кислотность, тем большее количество инородного начала находится в кислотном спирте; и наоборот, чем более резки разъедающая сила и кислотность, тем больше кислотный спирт содержит своего собственного начала. Эта истина широко подтверждается in опытом. Так, даже самые сильные кислоты, опресненные винным спиртом, обычно очень ослабляются. Хотя вода также ослабляет кислоту, однако, что различие между ними не может происходить от различного количества воды, это совершенно очевидно из того, что кислоты, и разведенные водою, сохраняют присущие каждой качества. [2]
Очевидно, что дело частиц кислотного спирта при растворении — вводить в поры металлов частицы воздуха, а воздуха — вновь приобретя упругость, отрывать частицы металла. [3]
Все кислоты, или как их называет Ломоносов, кислотные спирты или кислые соли, окрашивают фиалковый сироп в красный цвет, сходны по разъедающей способности и кислому вкусу, но различаются разной силой. [4]
При растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия склянки вырывается горючий пар, который представляет собой не что иное, как флогистон. Термин флогистон в переводе с греческого означал воспламеняющийся, горючий. Переведите слова Ломоносова на современный язык. [5]
Под колоколом воздушного насоса при вытягивании воздуха кипение возбуждается в кислотных спиртах гораздо труднее, чем в воде; отсюда видно, что воздух прочнее закреплен в порах кислотных спиртов, чем в порах воды, и что, следовательно, этот воздух проникает в поры твердых тел с названными спиртами легче, чем с водой. [6]
Металлы, расплавленные на самом сильном огне, вскипают и, подобно кислотному спирту и воде, выбрасывают пузырьки воздуха — ясное указание, что в металлах, так же как и в кислотных спиртах и воде, содержится воздух, рассеянный в порах HXJ теплотою он из них изгоняется, в силу собственной легкости поднимается вверх и образует пузырьки. [7]
Когда для растворения металла берутся две равных порции одного и того же кислотного спирта, но одна из них немного разбавлена прилитой водою, то таковая растворяет большее количество металла, чем первая, вследствие большего количества воздуха, рассеянного в большем объеме. [8]
Когда для рас творения металла берутся две равных порции одного и того же кислотного спирта, но одна из них немного разбавлена прилитой водою, то таковая растворяет большее количество металла, чем первая, вследствие большего количества воздуха, рассеянного в большем объеме. [9]
В 1745 г. М. В. Ломоносов писал: При растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия склянки вырывается горючий пар, который представляет собой не что иное, как флогистон [ 4, стр. Последнее замечание примечательно в двух отношениях: во-первых, за много лет до Кавендиша ( см. стр. [10]
Под колоколом воздушного насоса при вытягивании воздуха кипение возбуждается в кислотных спиртах гораздо труднее, чем в воде; отсюда видно, что воздух прочнее закреплен в порах кислотных спиртов, чем в порах воды, и что, следовательно, этот воздух проникает в поры твердых тел с названными спиртами легче, чем с водой. [11]
Металлы, расплавленные на самом сильном огне, вскипают и, подобно кислотному спирту и воде, выбрасывают пузырьки воздуха — ясное указание, что в металлах, так же как и в кислотных спиртах и воде, содержится воздух, рассеянный в порах HXJ теплотою он из них изгоняется, в силу собственной легкости поднимается вверх и образует пузырьки. [12]
Сопоставляя эти явления друг с другом, мы находим, что они в одних случаях одинаковы, в других — противоположны. Из последних самые известные такие: кислотные спирты при растворении металла нагреваются, а вода при растворении солей охлаждается. Эти явления обусловлены противоположными причинами, и мы подозреваем, что металлы в кислых спиртах растворяются иначе, чем соли в воде. И так как опыты, сделанные нами с растворами в пустоте, оказались вполне отвечающими ранее выработанной нами теории, то мы этими опытами подкрепляем ее как построенную теперь на верном основании. [13]
Сопоставляя эти явления друг с другом, мы находим, что они в одних случаях одинаковы, в других — противоположны. Из последних самые известные такие: кислотные спирты при растворении металла нагреваютсяи, а вода при растворении солей охлаждается. Эти явления обусловлены противоположными причинами, и мы подозреваем, что металлы в кислых спиртах растворяются иначе, чем соли в воде. [14]
Мы знаем, что их мне-ние известно всем, изучающим химию, и даже принято многими; поэтому мы считаем, что было бы непозволительно пройти мимо него, тем более, что оно представляется не совсем ложным. Что воздушный элемент может быть носителем кислотного спирта, и притом — именно селитряного, видно из того, что 1) огнедышащие горы, поглотив сернистую материю, извергают большое количество кислотного спирта, как выделяют его и подземные пещеры; 2) что немало его выдыхают пахучие растения, изобилующие кислым соком, при произрастании и брожении. Очевидно, что из первого источника происходит купоросная кислота, из второго — селитряная. [15]
Страницы: 1 2 3
www.ngpedia.ru
FTF 4 semestr / 22
Химические свойства спиртов
Химические свойства спиртов определяются наличием в них гидроксильной группы. Поскольку гидроксильная группа является полярной, она может гетеролитически диссоциировать, особенно, под действием сильных оснований. Таким образом, спирты проявляют свойства слабых кислот. Кроме того, высокая электроотрицательность кислорода обуславливает наличиеэлектрофильного атома углерода и, соответственно, способность спиртов подвергаться реакциям нуклеофильного замещения под действием ряда нуклеофилов. Наконец, атом кислорода гидроксильной группы имеет нуклеофильный характер, поэтому спирты могут выступать нуклеофилами в реакциях замещения и присоединения. Также для спиртов характерны реакцииокисления.
Диссоциация и кислотно-основные свойства спиртов
Кислотные свойства спиртов
Спирты способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты диссоциируют по связи O–H с образованием алкоксид-иона. Кислотные характеристики спиртов оценивают по константе кислотности Ka.
В водном растворе кислотность спиртов снижается с увеличением молекулярной массы и разветвлённости углеводородной цепи. Это связывают с увеличением положительного индуктивного эффекта алкильных заместителей в данном ряду и уменьшением устойчивости образующегося алкоксид-иона за счёт локализации отрицательного заряда на атоме кислорода[88]. В целом, электроноакцепторные заместители (–NO2, –CN, –F, –Cl, –Br, –I, –OR и др.) увеличивают кислотность спиртов (уменьшают pKa). Напротив, электронодонорные заместители (например, алкильные заместители) уменьшают кислотность спиртов (увеличивают pKa). Так, pKa 2,2,2-трифторэтанола имеет значение 12,43 (против 15,9 у этанола), а полностью фторированного трет-бутанола — 5,4 (против 17,7 у трет-бутанола)[89]. Сравнительная кислотность спиртов и соединений других классов схематически представлена на рисунке[90].
Как слабые кислоты, спирты вступают в реакции с щелочными, щелочноземельными и некоторыми другими металлами, и с сильными основаниями, например, гидридами или амидамиметаллов, реактивами Гриньяра[91].
Осно́вные свойства спиртов
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы скислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
Количественно основность спиртов оценивают по константе основности pKb или связанной с ней константе кислотности сопряжённой кислоты pKaH+:
Спирты являются слабыми основаниями, и их основность возрастает с увеличением длины или разветвлённости углеводородного радикала при гидроксильной группе. Данный эффект наблюдается из-за роста положительного индуктивного эффекта радикала в данном ряду, за счёт которого увеличивается отрицательный заряд на атоме кислорода гидроксильной группы[92].
Нуклеофильное замещение
Основная статья: Реакции нуклеофильного замещения
Атом углерода, непосредственно соединённый с гидроксильной группой, имеет частичный положительный заряд, что делает возможной атаку нуклеофильной частицы (галогенид-иона,аммиака, спирта и др.) по этому атому углерода с замещением гидроксильной группы на эту частицу. Гидроксильная группа является плохой уходящей группой, поэтому обычно необходима её дополнительная активация.
Реакции нуклеофильного замещения в спиртах легче протекают в кислой среде, поскольку гидроксильная группа спирта протонируется, и фактической уходящей частицей является негидроксид-ион OH−, а молекула воды H2O. Кислотными свойствами может обладать сам реагент (часто используют галогеноводородные кислоты), так и специально добавленная неорганическая кислота, например, серная кислота[93].
Замещение гидроксильной группы также протекает под действием галогенидов серы и фосфора (SOCl2, PBr3, PBr5, POCl3 и др.). В данном случае ключевую роль выполняет соединение серы или фосфора, образующее активированный интермедиат с молекулой спирта[94].
Гидроксильную группу также превращают в сульфонатную группу, которая является хорошей уходящей группой. Для этих целей спирт сначала превращают в сульфонат, который затем подвергают реакции нуклеофильного замещения. В качестве реагентов для модификации гидроксильной группы обычно используют метансульфонилхлорид или п-толуолсульфонилхлорид (англ.)русск.[95].
Дегидратация
В присутствии кислотных катализаторов (оксид алюминия, серная кислота, фосфорная кислота и др.) спирты могут подвергаться дегидратации с образованием алкенов. Например, дегидратация этилового спирта приводит к образованию этилена. Реакция протекает в соответствии с правилом Зайцева, согласно которому при дегидратации образуется более устойчивый, более замещённый при двойной связи алкен[96].
Окисление
См. также: Реакции окисления спиртов
Под действием различных окислителей первичные спирты окисляются до альдегидов и далее — до карбоновых кислот, причём остановить реакцию на стадии образования альдегидов, предотвратив их дальнейшее окисление удаётся только за счёт использования специальных реагентов (хлорхромата пиридиния PCC и дихромата пиридиния PDC).
Вторичные спирты окисляются до кетонов. Реакцию обычно проводят под действием реагента Джонса (CrO3—серная кислота). Дальнейшее окисление кетонов протекает только в жёстких условиях с разрушением углеродного скелета.
Третичные спирты окисляются только в весьма жёстких условиях с разрушением углеродного скелета[97].
studfiles.net

