В чем есть белки, протеины и обычные продукты
Для того, чтобы обеспечить свой организм белками в нужном составе и в достаточном количестве, нужно понимать, как это сделать правильно. В этой статье делается попытка подробно ответить на этот вопрос.
Что собой представляет белок и сколько его необходимо организму
Белок есть в разных продуктах, но в разном количестве
Человеческому организму для здоровой жизни требуется много различных веществ. Белок — это один из основных таких материалов. Он в организме выполняет несколько различных функций.
Белок можно назвать основным строительным материалом, который необходим для восстановления различных тканей.
Кроме того, как известно, в человеческом организме на постоянной основе происходит распад старых клеток и постоянный рост новых, приводящий к фактическому обновлению человеческого тела не регулярной основе. Это можно назвать основной функцией белка, но она не является единственной.
Важную роль в организме играет деятельность различных ферментов. Все компоненты, которые в ней участвуют, имеют белковые компоненты и без этого материала функционируют не будут. При недостатке белка в организме по той или иной причине нормально функционировать они не смогут.
Все знают о том, что кислород жизненно важен для жизнедеятельности. Как известно, внутри человеческого организма он переносится с помощью гемоглобина, который представляет собой белковое соединение.
Человек в течение каждого дня тратит на свою жизнедеятельность определенное количество белка, которое необходимо восполнять в полном объеме. Какими путями это обычно делается? Конечно наибольшая часть белков, которая поступает в человеческий организм, поступает вместе с пищей. Однако, существуют и другие способы.
Дело в том, что белки представляют собой довольно сложные органические соединения. Для того, чтобы их усвоить, обычно необходимо их химически разложить на составные части — аминокислоты. После этого внутри организма синтезируются нужные ему белки.
В наше время состав аминокислот активно изучается, при этом считается, что человек использует примерно около сотни аминокислот. При этом не все они в одинаковой степени участвуют в процессах метаболизма. Наиболее активными в этом отношении являются примерно двадцать аминокислот. При таком большом разнообразии важно, чтобы все их разновидности поступали в организм.
Однако, на практике обычно так не происходит. В таком случае природа предусмотрела, что недостающие аминокислоты синтезируются внутри человеческого тела в необходимых количествах. Однако, это возможно не во всех случаях.
Некоторые аминокислоты являются незаменимыми. Если они не поступают человеку вместе с едой, взять их будет неоткуда. Конечно, важно понимать, сколько именно белка нужно потреблять для того, чтобы удовлетворить потребность человеческого организма.
Ученые в течение десятилетий стремятся ответить на этот вопрос. В 19 и 20 веках различные рекомендации находились в пределах от 26 до 136 граммов в сутки. Такой разброс цифр говорит о сложности рассматриваемого вопроса.
В настоящее время принято считать, что нужное количество потребляемых белков составит 100 — 120 грамм в сутки. Однако, нужно отметить, что более точные цифры определяются весом человека.
Сложность рассматриваемого вопроса состоит также в том, что такая потребность может с течением времени меняться. Например, если рассматривать условия, когда происходят существенные физические или умственные нагрузки, то в такие периоды потребность в поступлении белка в организм увеличивается.
Что происходит в тех случаях, когда потребление белка недостаточно? Это может привести к довольно неприятным последствиям. Одним из них может стать наступление гормонального дисбаланса.
При недостатке белков в организме разбалансируется работа ферментативных систем в организме. Может наступить обычная пищевая дистрофия. Недостаток белков может привести к существенному ухудшению мозговой деятельности. Эта причина оказывает отрицательное влияние на процесс кроветворения.
Недостаток поступления этих веществ может привести к ухудшению функционирования печени и других органов.
Особенно опасен недостаток белков для детского, растущего организма. В таких случаях это может стать причиной замедления как физического, так и умственного развития.
В частности, дефицит белков ухудшает работу гипофизарного отдела детского мозга, который вырабатывает вещество (соматотропный гормон), влияющие на развитие ребенка. Если белковая недостаточность очень сильна, это может вызвать дистрофию. А затем и смерть ребенка.
Какими бывают протеины?

Белковая пища — еда спортсменов
Белок играет важную роль для спортсменов, которые наращивают мышечную массу. Он является строительным материалом для мускулов. Поэтому очень важным в таких случаях является обеспечить полное и сбалансированное белка в организм.
С этой целью выпускаются специальные препараты, которые называют протеинами. Обычно их употребляют в виде протеинового коктейля. Когда он попадает в человеческий организм, он переваривается и распадается при этом на составляющие элементы, которые называются аминокислотами. Именно в таком виде и происходит усвоение белков организмом человека.
Потребность спортсменов в белке больше, чем у обычных людей. Конечно, обеспечить поступление белка в нужном объеме можно и путем съедания большего количества еды. Однако, в некоторых случаях это может привести к ожирению.
Поэтому принято употреблять специальные продукты для этой цели.
При этом они выполняют еще одну важную для организма функцию: поддерживают естественный азотный баланс. Это косвенно поддерживает процессы создания мышечных тканей. Протеины содержат не только сам белок, но и некоторые компоненты, которые способствуют его усвоению. Применяется несколько основных разновидностей протеина.
Один из них называют сывороточным. Название отражает тот факт. Что производят его из молочной сыворотки. Содержание белка в таком протеине составляет двадцать процентов. Важной особенностью такого вида протеинов является то, что он содержит полностью все незаменимые аминокислоты.
Еще одной важной особенностью является высокая скорость усвоения белка организмом. Рекомендуется употреблять короткими порциями несколько раз в день. Другой вид протеина — молочный. В нем содержится 20% сывороточного белка и 80% казеинового белка. Он является неразделенной смесью белков и характеризуется средней скоростью усвоения.
Соевый протеин содержит белок растительного происхождения. Он содержит весь комплекс аминокислот (в том числе незаменимых), который нужен для роста мышечной массы.
Как известно, некоторые люди по каким-то причинам не могут употреблять молочный белок. Для них это может быть оптимальным вариантом. Протеин усваивается медленно и оказывает воздействие на снижение холестерина в крови. Яичный протеин характеризуется наиболее высокой скоростью усвоения человеческим организмом.
Несмотря на высокую биологическую активность, на рынке распространен мало из-за своей относительно высокой стоимости. Казеиновый протеин вырабатывается из молочных продуктов. Несмотря на то, что усваивается он медленно, его употребление позволяет спортсмену обеспечить длительное и сбалансированное поступление белка в организм.
Также нужно упомянуть комплексный протеин. Он представляет собой точно подобранную смесь различных разновидностей этого продукта, которая имеет набольшую эффективность.
В чем есть белки
Белок может быть растительного или животного происхождения
В основном белки поступают в организм вместе с различными мясомолочными продуктами. Это не только непосредственно мясо, рыба и молоко, но и творог, сыр, яйца, птица и другие подобные продукты. Но это не единственные источники белка для человеческого организма. Данный белок принято называть животным.
Еще одним источником белка является растительная пища. К наиболее ценным источникам такого рода относятся: горох, фасоль, грибы и орехи. Те, кто не употребляет в еду продукты животного происхождения, могут получать необходимый белок из такого рода растительной пищи.
Какой тип белка более полезен? Тот, который поступает с пищей животного происхождения или тот, приходящий вместе с растительной пищей? Белок животного происхождения является более насыщенным, более качественным и сбалансированным по своему составу.
Как известно, потребности человеческого организма в белке включают в себя необходимость получить в нужном количестве около сотни различных аминокислот. В такого рода пище содержатся все нужные элементы.
В продуктах растительного происхождения содержаться в основном именно те белки, которые участвуют в росте различных тканей и органов. Во фруктах и ягодах содержание белков является наименьшим по сравнению с другими продуктами.
Как употреблять белки, если хочешь похудеть
Белок — важный элемент!
Если человек занимается похудением, норма потребления белков должна соответствовать определенным правилам.
Ежедневное количество белков в расчете на один килограмм веса тела в такой ситуации составляет примерно от полутора до двух граммов на один килограмм веса.
За один прием пищи нет смысла съедать более 30 граммов, так как излишек организмом усваиваться не будет.
Излишек белка в организме
Конечно, белок для организма жизненно важен. Но можно ли его употреблять без всякой меры и чем это может грозить?
Усвоение излишнего белка требует много кальция, который для этого будет извлекаться из других тканей и органов организма. Обычно он поступает из костей. Организм при этом не успевает компенсировать его и кости становятся хрупкими, может развиться остеопороз.
Перенасыщение белком также может привести к повышенному уровню холестерина, что повышает риск возникновения и развития сердечно-сосудистых заболеваний. Также переизбыток белка способен привести к дефициту витаминов в человеческом организме.
Белки — незаменимые аминокислоты, это докажет видеосюжет:
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Расскажите друзьям! Расскажите об этой статье своим друзьям в любимой социальной сети с помощью социальных кнопок. Спасибо!
Поделиться
Поделиться
Твит
Телеграм
Класс
Вотсап
pishhevarenie.com
5.Белки, их строение и функции.
Белки и их строение.
Среди органических компонентов клетки самыми важными являются белки. Они очень разнообразны и по строению, и по функциям. Содержание белков в различных клетках может колебаться от 50 до 80%. Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн углеродных единиц) органические соединения. Кроме С, О, Н, N, в состав белков могут входить S, Р, Fe. Белки построены из мономеров, которыми являются аминокислоты. Поскольку в состав молекул белков может входить большое число аминокислот, то их молекулярная масса бывает очень большой.
В клетках разных живых организмов встречается свыше 170 различных аминокислот, но бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т. е. различных белков, которые будут обладать совершенно одинаковым составом, но различным строением. Но и это огромное число не предел — белок может состоять и из большего числа аминокислотных остатков, и, кроме того, каждая аминокислота может встречаться в белке несколько раз.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—Nh3) с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение (рис. 12).
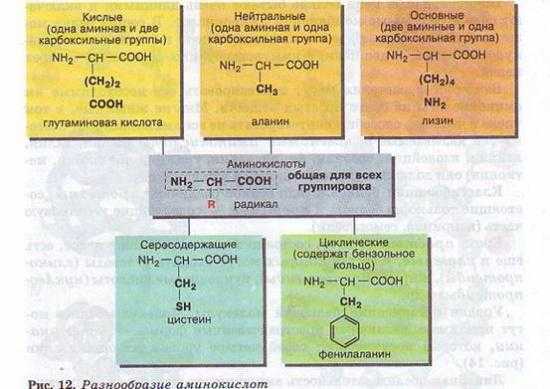
Наличие в одной молекуле аминокислоты и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Через эти группы происходят соединения аминокислот при образовании белка. В ходе реакции полимеризации выделяется молекула
Полипептидные цепи белков бывают очень длинными и включают самые различные комбинации аминокислот. В состав белка может входить не одна, а две полипептидные цепи и более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырех цепей.
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде.
Классификация белков.
Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин).
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
Уровни организации белковой молекулы.
Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации (рис. 14).
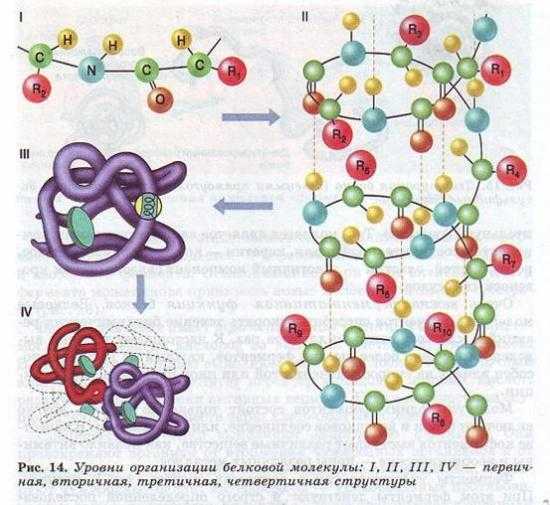
Линейная последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Вторичная структура белков возникает в результате образования водородных связей между группами —СООН и —Nh3 -разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными ( — S-S-) связями между остатками цистеина, а также гидрофобным взаимодействием.
Четвертичная структура характерна не для всех белков.
Она возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц.
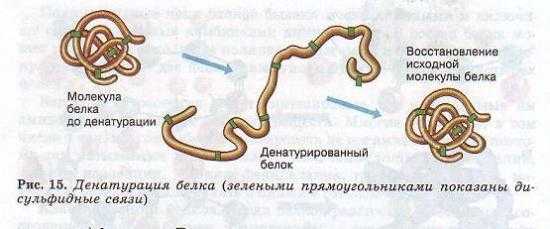
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру (рис. 15). Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Функции белков.
Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны.
Белки являются основой всех биологических мембран, всех органоидов клетки, таким образом они выполняют структурную (строительную ) функцию.- (Рис. 15.) . Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Очень важна ферментативная функция белков.
Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции.
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент, В качестве коферментов выступают различные вещества, как правило
Ферменты участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в строго определенной последовательности, они специфичны для каждого вещества и ускоряют только определенные реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром.
Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре, Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
На заключительном этапе химической реакции комплекс «фермент—субстрат» распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества-субстрата (рис. 16).
Важное значение имеет транспортная функция белков.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки. Протеины. Протеиды. Пептид. Пептидная связь. Простые и сложные белки. Первичная, вторичная, третичная и четвертичная структуры белков. Денатурация. 1. Какие вещества называются белками? 2. Что такое первичная структура белка? 3. Как образуются вторичная, третичная и четвертичная структуры белка? 4. Что такое денатурация белка? 5. По какому признаку белки делятся на простые и сложные? 6. Какие функции белков вам известны? 7. Какую роль выполняют белки-гормоны? 8. Какую функцию выполняют белки-ферменты? 9. Почему белки редко используются в качестве источника энергии?
Белок яйца является типичным протеином. Выясните, что с ним произойдет, если на него подействовать водой, спиртом, ацетоном, кислотой, щелочью, растительным маслом, высокой температурой и т. д.
1. Измельчите клубень сырого картофеля до состояния кашицы. Возьмите три пробирки и в каждую положите небольшое количество измельченного картофеля.
Первую пробирку поместите в морозилку холодильника, вторую — на нижнюю полку холодильника, а третью — в банку с теплой водой (t = 40 °С). Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты.
Возьмите три пробирки и в каждую из них положите небольшое количество измельченного сырого картофеля. В первую пробирку с картофелем капните несколько капель воды, во вторую — несколько капель кислоты (столовый уксус), а в третью — щелочи. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. Сделайте выводы. Ферменты значительно превосходят другие катализаторы по специфичности, каталитической активности и способны действовать в мягких условиях (невысокие температуры, нормальное давление и т.д.). Они способны в течение миллисекунд обеспечить протекание сложных многостадийных реакций, для проведения которых химику в современной лаборатории потребовались бы дни, недели или даже месяцы. Например, одна молекула фермента каталазы расщепляет в 1 мин более 5 млн молекул пероксида водорода (Н2О2), который образуется в организме при окислении различных соединений. Так как молекулы белков, построенные из аминокислот, необычайно велики и сложны, то для их изображения используют специальную общепринятую символику. Каждая аминокислота обозначается тремя латинскими буквами. Многие живые организмы способны вырабатывать одни аминокислоты из других и поэтому им не очень важно, какие аминокислоты содержатся в белках пищи. Но некоторые животные, в том числе человек, должны получать подавляющее число аминокислот с пищей, так как ряд аминокислот, называемых незаменимыми, в их организме не вырабатывается, но они необходимы для жизнедеятельности.
studfiles.net
§ 10. Классификация белков
§ 10. КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).
Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2 протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис. 21).
Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).
Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.
Классификация по функциям
По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др.
Структурные белки
К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции ( рис. 23).
Рис. 23. Клеточная мембрана.
Питательные и запасные белки
Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.
Сократительные белки
Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных.
Транспортные белки
Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты
Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Защитные белки
К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию.
Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
фибриноген фибрин.
Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Рецепторные белки
Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.25. Передача внешних сигналов в клетку
Регуляторные белки
Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
ebooks.grsu.by
Белки | Наука | FANDOM powered by Wikia
Файл:Myoglobin.pngБелки́ — сложные высокомолекулярные природные органические вещества, построенные из аминокислот, соединённых пептидными связями. Последовательность аминокислот в белке определена геном и зашифрована в генетическом коде. Хотя это генетическое кодирование определяют 22 «стандартные» аминокислоты, расположение их в белке (протеине) дает возможность создания бесчисленного количества разных протеинов. Белки могут работать совместно, для того чтобы достигнуть определенной функции, и они часто связываются для того чтобы сформировать стабилизированный комплекс.
История изучения Править
Названние «протеин» (синоним «белку») происходит от греч. πρώτα; («прота»), то есть — «главным образом важности». Изначально белки были описаны и приобрели название только в 1838 году. Однако их центральная роль в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что уреаза энзима была белком.
Структура белка Править
Файл:Peptide-bond-planes-n-rotation.pngМолекулы белков представляют собой линейные полимеры, состоящие из 22 основных L-α-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме, новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Белки длиной от 2 до 100 аминокислотных остатков часто называют пептидами, при большей степени полимеризации — протеинами, хотя это деление весьма условно.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде поcледовательности нуклеотидов, причем одной аминокислоте соответсвует одна или несколько последовательностей из трех нуклеотидов — так называемых триплетов или кодонов. То, какая аминокислота соответствует данному кодону в мРНК определяется генетическим кодом, который может несколько отличаться у разных организмов.
Гомологичные белки (выполняющие одну функцию и предположительно имеющие общее эволюционного происхождение, например, гемоглобины) разных организмов имеют во многих местах цепи различные аминокислотные остатки, называемые вариабельными, в противоположность инвариантным, общим остаткам. По степени гомологии возможна оценки эволюционного расстояния между таксонами.
Простые и сложные белки Править
Выделяют простые белки (протеины) и сложные белки (протеиды). Простые белки содержат только аминокислоты, связанные в цепочку. Сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Многие белки эукариот, например, имеют полисахаридные цепи, которые помогают белку принимать нужную конформацию и придают дополнительную стабильность. Дисульфидные мостики также играют роль как элементы необходимые при принятии белком правильной 3-х мерной формы, и являются главным компонентом сложных белков. Но важно заметить, что в основном только эукариоты способны на синтезирование сложных белков (протеидов), так как прокариоты не имеют достаточно компартментализации для создания дополнительных изменений, присутствующих в сложных белках, и даже если могут это делать в периплазматическом пространстве , то это случается либо редко, либо неэффективно.
Уровни структуры белка Править
Файл:Proteinviews-1tim.pngКроме последовательности (первичной структуры), крайне важна трехмерная структура белка, которая формируется в процессе фолдинга (от англ. folding, т.е. сворачивание). Показано, что несмотря на огромные размеры молекул, природные белки имеют лишь одну конформацию, утратившие структуру белки теряют свои свойства.
Выделяют четыре уровня структуры белка:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 4 аминокислотных остатка, спираль стабилизорована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль может быть построена исключительно из одного типа стереоизомеров аминокислот (L или D), хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина, близкорасположенные аспарагин, серин, треонин и лейцин могут стерически мешать образованию спирали, пролин вызывает изгиб цепи и также нарушает α-спирали.
- π-спирали;
- $ 3_{10} $-спирали;
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между разными цепями, а не внутри одной, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в разные стороны (антипараллельная ориентация). Для образования листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
- неупорядоченные фрагменты.
- Третичная структура
- — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие:
- Четверичная структура
- — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Также выделяют:
- Трёхмерную структуру белка — набор пространственных координат, составляющих белок атомов.
- Cубъединичную (доменную) структуру белка — последовательность участков белка, имеющих известную функцию или определенную трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.
Денатурация Править
Биосинтез белка Править
Функции белков в организме Править
Так как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, и участвуют в каждом внутреннем процессе клетки. Они являются обязательными компонентами в питании человека и животных, так как не все необходимые аминокислоты могут синтезироваться в организме, и должны поступать из еды. Через процесс пищеварения животные разлагают поглощенные белки при помощи ферментов (также белковой природы) на свободные аминокислоты, которые потом можно использовать для синтезирования нужных протеинов.
Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл или секретируются во внеклеточное пространство.
- Структурная функция
- Структурные белки, такие как коллаген и эластин обеспечивают фиброзную основу соединительных тканей у животных. Белки входят в состав клеточных мембран. Также белки формируют цитоскелет, обеспечивающий поддержание формы клетки и участвующий во внутриклеточном транспорте.
- Каталитическая функция
- Ферменты (энзимы), которые служат катализаторами химических реакций в организме. Известно несколько тысяч ферментов, среди них, наример, пепсин, расщепляет белки в процессе пищеварения.
- Защитная функция
- Белки, составляющие имунную систему, защищают организм от патогенов, путем генерации имунного ответа. Примеры — антитела (иммуноглобулины), нейтрализующие бектрии, вирусы или чужеродные белки, фибриногены и тромбины, участвующие в свёртывании крови.
- Регуляторная функция
- Полипептидные (белковые) гормоны и цитокины. Примеры — инсулин, который регулирует концентрацию глюкозы в крови и фактор некроза опухолей, который передает сигналы воспаления.
- Транспортная функция
- Транспортные белки, такие как гемоглобин, который переносит кислород из легких к остальным тканям и углекислый газ от тканей к легким.
- Энергетическая функция
- Как запасной источник энергии. При полном расщеплении 1 г белка выделяется 17,6кДж энергии.
- Запасная (резервная) функция белков
- К таким белкам относятся так называемые резервные белки, являющиеся источниками питания для развития плода; белки яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
- Рецепторная функция
- В мембрану клетки встроены белки, способные изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача информации в клетку.
- Моторная и сократительные функции
- Целый класс моторных белков, участвует в сокращении мышц (миозин), активном и направленном внутриклеточном транспорте (кинезин, динеин).
af:Proteïen
ar:بروتين
bg:Белтък
bs:Bjelančevine
ca:Proteïna
cs:Bílkovina
da:Protein
de:Protein
el:Πρωτεΐνη
en:Protein
eo:Proteino
es:Proteína
et:Valk
eu:Proteina
fa:پروتئین
fi:Proteiini
fr:Protéine
gl:Proteína
he:חלבון
hr:Bjelančevine
hu:Fehérje
id:Protein
io:Proteino
is:Prótín
it:Proteina
ja:蛋白質
ko:단백질
lb:Protein
lt:Baltymas
lv:Olbaltumviela
mk:Протеин
mn:Уураг
nl:Proteïne
nn:Protein
no:Protein
pam:Protina
pl:Białko
pt:Proteína
ro:Proteină
sh:Protein
simple:Protein
sk:Bielkovina
sl:Beljakovina
sr:Протеин
su:Protéin
sv:Protein
ta:புரதம்
th:โปรตีน
tr:Protein
ug:ئاقسىل
uk:Білок
vi:Protein
yi:פראטין
zh:蛋白质
zh-min-nan:Nn̄g-pe̍h-chit
ru.science.wikia.com
Белки Определение Пептиды и белки представляют собой высокомолекулярные
Белки
Определение Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями.
Функции белков 1) Структурная (пластическая) – белками образованы многие клеточные компоненты, а в комплексе с липидами они входят в состав клеточных мембран. 2) Каталитическая – все биологические катализаторы – ферменты по своей химической природе являются белками.
3) Транспортная – белок гемоглобин транспортирует кислород, ряд других белков образуя комплекс с липидами транспортируют их по крови и лимфе (пример: миоглобин, сывороточный альбумин). 4) Механохимическая – мышечная работа и иные формы движения в организме осуществляются при непосредственном участии сократительных белков с использованием энергии макроэргических связей (пример: актин, миозин).
5) Регуляторная – ряд гормонов и других биологически активных веществ имеют белковую природу (пр.: инсулин, АКТГ). 6) Защитная – антитела (иммуноглобулины) являются белками, кроме того основу кожи составляет белок коллаген, а волос – креатин. Кожа и волосы защищают внутреннюю среду организма от внешних воздействий. В состав слизи и синовиальной жидкости входят мукопротеиды.
7) Опорная – сухожилия, поверхности суставов соединения костей образованы в значительной степени белковыми веществами (пр.: коллаген, эластин). 8) Энергетическая – аминокислоты белков могут поступать на путь гликолиза, который обеспечивает клетку энергией. 9) Рецепторная – многие белки участвуют в процесса избирательного узнавания(рецепторы).
Источники аминокислот Основным источником α- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α — аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α — аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся: валин, лейцин, треонин, метионин, триптофан и т.д.
Аминокислоты, участвующие в создании белков. Глицин Аланин Валин Лейцин Изолейцин Серин Треонин Цистеин
МЕТИОНИН ЛИЗИН АРГИНИН АСПАРАГИН АСПАРАГИНОВАЯ КИСЛОТА ГЛУТАМИНОВАЯ КИСЛОТА
ГЛУТАМИН ФЕНИЛАЛАНИН ТИРОЗИН ТРИПТОФАН ГИСТИДИН ПРОЛИН
Строение полипептидной цепи Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту.
Последовательное соединение аминокислот при образовании белковой молекулы. В качестве основного направления полимерной цепи выбран путь от концевой аминогруппы h3N к концевой карбоксильной группе COOH.
Структура белка Первичная структура белка — специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в полипептидной цепи.
Вторичная структура белка — конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – α- спираль.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей
Химические свойства 1) Амфотерность связана с наличием в молекуле белка катионообразующих групп – аминогрупп и анионообразующих – карбоксильных группу. Знак заряда молекулы зависит от количества свободных групп. Если преобладают карбоксильные группы то заряд молекулы отрицательный (проявляются свойства слабой кислоты), если аминогруппы – то положительный (основные свойства).
2) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д.
При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или при повышении температуры происходит разрушение вторичных и третичных структур без повреждения его первичной структуры, в результате белок теряет растворимость и утрачивает биологическую активность.
Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
3) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию a- аминокислот, из которых он был составлен.
4) Качественные реакции на белки: a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Превращения белков в организме
Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов), одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).
present5.com
Функции и структура белка :: SYL.ru
Белки представляют собой органические высокомолекулярные соединения. Эти вещества также называют протеинами, полипептидами. Далее рассмотрим, каковы структура и функции белков.
Общие сведения
Химическая структура белков представлена альфа-аминокислотами, соединенными в цепочку посредством пептидной связи. В живых организмах состав определяет генетический код. В процессе синтеза в большинстве случаев применяется 20 аминокислот стандартного типа. Множеством их комбинаций формируются белковые молекулы с самыми разнообразными свойствами. Аминокислотные остатки часто подвергаются посттрансляционным модификациям. Они могут возникнуть и до того, как белок станет выполнять свои функции, и в процессе его активности в клетке. В живых организмах часто несколько молекул формируют сложные комплексы. В качестве примера можно привести фотосинтетическое объединение.
Назначение соединений
Белки считаются важной составляющей питания человека и животных в связи с тем, что в их организмах все необходимые аминокислоты синтезироваться не могут. Часть их должна поступать вместе с белковой пищей. Основными источниками соединений выступают мясо, орехи, молоко, рыба, зерновые. В меньшей степени протеины присутствуют в овощах, грибах и ягодах. При пищеварении посредством ферментов потребленные белки подвергаются разрушению до аминокислот. Они уже используются в биосинтезе собственных протеинов в организме либо подвергаются распаду дальше — для получения энергии.
Историческая справка
Последовательность структуры белка инсулина была определена впервые Фредериеом Сенгером. За свою работу он получил Нобелевскую премию в 1958 году. Сенгер использовал метод секвенирования. С помощью дифракции рентгеновского излучения впоследствии были получены трехмерные структуры миоглобина и гемоглобина (в конце 1950 гг.). Работы проводили Джон Кендрю и Макс Перуц.
Структура молекулы белка
Она включает в себя линейные полимеры. Они, в свою очередь, состоят из остатков альфа-аминокислот, являющихся мономерами. Кроме того, структура белка может включать компоненты, имеющие неаминокислотную природу, и аминокислотные остатки модифицированного типа. При обозначении компонентов применяются 1- либо 3-буквенные сокращения. Соединение, в состав которого входит от двух до нескольких десятков остатков, именуется часто как «полипептид». В результате взаимодействия альфа-карбоксильной группы одной аминокислоты с альфа-аминогруппой другой появляются (в процессе формирования структуры белка) связи. В соединении выделяют С- и N- концы, в зависимости от того, какая группа аминокислотного остатка является свободной: -СООН либо –NH2. В процессе синтеза белка на рибосоме в качестве первого концевого выступает, как правило, остаток метионина; присоединение последующих осуществляется к С-концу предыдущих.
Уровни организации
Они были предложены Линдрем-Лангом. Несмотря на то что данное деление считается несколько устаревшим, им все еще пользуются. Было предложено выделять четыре уровня организации соединений. Первичная структура молекулы белка определяется генетическим кодом и особенностями гена. Для более высоких уровней характерно формирование в ходе сворачивания протеина. Пространственная структура белка определяется в целом аминокислотной цепью. Тем не менее она достаточно лабильна. На нее могут оказывать влияние внешние факторы. В связи с этим более корректно говорить о конформации соединения, наиболее выгодной и предпочтительной энергетически.
1 уровень
Он представлен последовательностью аминокислотных остатков полипептидной цепи. Как правило, его описывают с использованием одно- либо трехбуквенных обозначений. Первичная структура белков отличается устойчивыми сочетаниями аминокислотных остатков. Они выполняют определенные задачи. Такие «консервативные мотивы» остаются сохраненными в ходе видовой эволюции. По ним достаточно часто можно предсказывать задачу неизвестного протеина. Оценивая степень сходства (гомологии) в аминокислотных цепях от различных организмов, можно определять эволюционное расстояние, образующееся между таксонами, которые составляют эти организмы. Первичная структура белков определяется методом секвенирования либо по исходному комплексу его мРНК с использованием таблицы генетического кода.
Локальное упорядочивание участка цепи
Это следующий уровень организации – вторичная структура белков. Существует несколько ее типов. Локальное упорядочивание участка цепи полипептида стабилизируется водородными связями. Наиболее популярными типами считаются:
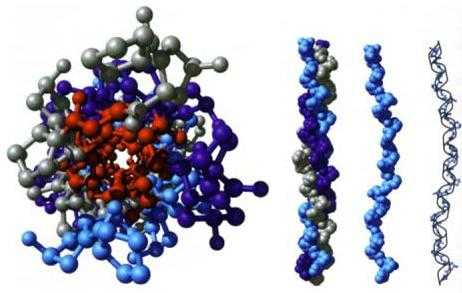
- Альфа-спирали. Они представлены в виде плотных витков вокруг длинной молекулярной оси. Один оборот составлен посредством 3.6 аминокислотных остатков. Шаг спирали – 0.54 нм. Эта вторичная структура белков стабилизируется взаимодействиями Н- и О-пептидными группами, которые отстают друг от друга на 4 звена. Альфа-спираль может быть как лево-, так и правозакрученной. Тем не менее, в белковых соединениях чаще всего выявляется последняя. Нарушать спираль могут электростатические взаимодействия аргинина, лизина, глутаминовой кислоты. Создавать стерические помехи при образовании могут находящиеся в непосредственной близости остатки лейцина, треонина, серина, аспарагина. Нарушение альфа-спирали (ее изгиб) вызывают части пролина.
- Бета-листы. Они представлены в виде нескольких полипептидных цепей зигзагообразной формы. В них водородные связи формируются между аминокислотами, сравнительно удаленными в первичной структуре, либо различными белковыми цепями. Соединения, как правило, ориентированы N-концами в противоположном направлении (антипараллельная ориентация). При формировании бета-листов значение имеют малые размеры, свойственные боковым группам аминокислот.
- Неупорядоченные фрагменты.
- 310- и π–спирали и прочие.

Пространственное строение
Третичная структура белков включает в себя элементы предыдущего уровня. Они стабилизируются разными типами взаимодействий. Важнейшее значение при этом имеют гидрофобные связи. В стабилизации участвуют:
- Ковалентные взаимодействия.
- Ионные связи, формирующиеся между боковыми аминокислотными группами, имеющими противоположные заряды.
- Водородные взаимодействия.
- Гидрофобные связи. В процессе взаимодействия с окружающими элементами Н2О происходит сворачивание протеина так, чтобы боковые неполярные аминокислотные группы оказывались изолированными от водного раствора. Гидрофильные группы (полярные) оказываются на поверхности молекулы.
Третичная структура белков определяется методами магнитного (ядерного) резонанса, некоторыми видами микроскопии и прочими способами.
Принцип укладки
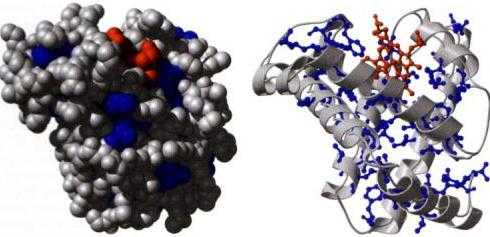
Исследования показали, что между 2 и 3 уровнями удобно выделить еще один. Его именуют «архитектурой», «мотивом укладки». Он определяется взаиморасположением компонентов вторичной структуры (бета-тяжей и альфа-спиралей) в границах компактной глобулы — белкового домена. Он может существовать самостоятельно либо быть включенным в состав более крупного протеина вместе с прочими аналогичными. Установлено, что мотивы укладки достаточно консервативны. Они встречаются в протеинах, не обладающих ни эволюционными, ни функциональными связями. Определение архитектуры лежит в основе рациональной (физической) классификации.
Доменная организация
При взаимном расположении нескольких цепей полипептидов в составе одного протеинового комплекса формируется четвертичная структура белков. Элементы, входящие в ее состав, образуются по отдельности на рибосомах. Только по завершении синтеза начинает образовываться данная структура белка. Она может содержать как различающиеся, так и идентичные полипептидные цепи. Четвертичная структура белков стабилизируется за счет тех же взаимодействий, что и на предыдущем уровне. Некоторые комплексы могут включать в себя несколько десятков протеинов.
Структура белка: защитные задачи
Полипептиды цитоскелета, выступая в некотором роде в качестве арматуры, придают многим органоидам форму, участвуют в ее изменении. Структурные протеины обеспечивают защиту организма. К примеру, таким белком является коллаген. Он формирует основу в межклеточном веществе соединительных тканей. Также защитной функцией обладает кератин. Он составляет основу рогов, перьев, волос и прочих производных эпидермиса. При связывании белками токсинов во многих случаях происходит детоксикация последних. Так выполняется задача по химической защите организма. Особенно важную роль в процессе обезвреживания токсинов в человеческом организме играют печеночные ферменты. Они способны расщеплять яды или переводить их в растворимую форму. Это способствует более быстрой транспортировке их из организма. Белки, присутствующие в крови и прочих биологических жидкостях, обеспечивают иммунную защиту, вызывая реакцию как на атаку патогенов, так и на повреждение. Иммуноглобулины (антитела и компоненты системы комплемента) способны нейтрализовывать бактерии, чужеродные протеины и вирусы.
Механизм регуляции
Белковые молекулы, не выступающие ни в качестве источника энергии, ни как строительный материал, контролируют многие внутриклеточные процессы. Так, за счет них осуществляется регулирование трансляции, транскрипции, слайсинга, деятельность прочих полипептидов. Механизм регуляции основывается на ферментативной активности или проявляется благодаря специфичному связыванию с прочими молекулами. К примеру, факторы транскрипции, полипептиды-активаторы и протеины- репрессоры способны контролировать интенсивность генной транскрипции. При этом они взаимодействуют с регуляторными последовательностями генов. Важнейшая роль в контроле над течением внутриклеточных процессов отводится протеинфосфатазам и протеинкиназам. Эти ферменты запускают либо подавляют активность прочих белков посредством присоединения или отщепления от них фосфатных групп.
Сигнальная задача
Ее часто объединяют с регуляторной функцией. Это связано с тем, что многие внутриклеточные, как и внеклеточные, полипептиды могут передавать сигналы. Такой способностью обладают факторы роста, цитокины, гормоны и прочие соединения. Стероиды транспортируются по крови. Взаимодействие гормона с рецептором выступает в качестве сигнала, за счет которого запускается ответная реакция клетки. Стероиды контролируют содержание соединений в крови и клетках, размножение, рост и прочие процессы. В качестве примера можно привести инсулин. Он регулирует уровень глюкозы. Взаимодействие клеток осуществляется посредством сигнальных белковых соединений, передаваемых по межклеточному веществу.
Транспорт элементов
Растворимые протеины, участвующие в перемещении малых молекул, имеют высокое сродство к субстрату, присутствующему в повышенной концентрации. Они обладают также способностью к легкому его высвобождению в областях с низким его содержанием. В качестве примера можно привести транспортный белок гемоглобин. Он перемещает из легких кислород к прочим тканям, а от них – переносит углекислый газ. В транспортировке малых молекул через стенки клетки, изменяя их, участвуют и некоторые мембранные белки. Липидный слой цитоплазмы обладает водонепроницаемостью. Благодаря этому предотвращается диффузия заряженных или полярных молекул. Мембранные транспортные соединения принято разделять на переносчиков и каналы.
Резервные соединения
Эти белки формируют так называемые запасы. Они накапливаются, например, в семенах растений, животных яйцеклетках. Такие белки выступают в качестве резервного источника вещества и энергии. Некоторые соединения используются организмом как аминокислотный резервуар. Они, в свою очередь, являются предшественниками активных веществ, участвующих в регулировании метаболизма.
Клеточные рецепторы
Такие белки могут располагаться как непосредственно в цитоплазме, так и встраиваться в стенку. Одной своей частью соединение принимает сигнал. В качестве него, как правило, выступает химическое вещество, а в ряде случаев – механическое воздействие (растяжение, к примеру), свет и прочие стимулы. В процессе воздействия сигнала на определенный фрагмент молекулы – полипептид-рецептор – начинаются ее конформационные изменения. Они провоцируют смену конформации остальной части, выполняющей передачу стимула на прочие компоненты клетки. Отправка сигнала может осуществляться разными способами. Одни рецепторы способны катализировать химическую реакцию, вторые – выступают в качестве ионных каналов, закрывающихся либо открывающихся под воздействием стимула. Некоторые соединения специфически связывают молекулы-посредники внутри клетки.
Моторные полипептиды
Существует целый класс белков, обеспечивающих движения организма. Моторные белки участвуют в сокращении мышц, перемещении клеток, активности жгутиков и ресничек. За счет них также выполняется направленные и активный транспорт. Кинезины и динеины осуществляют перенос молекул по ходу микротрубочек с использованием в качестве энергетического источника гидролиза АТФ. Вторые перемещают органоиды и прочие элементы по направлению к центросоме из периферических клеточных участков. Кинезины движутся в обратном направлении. Динеины, кроме того, отвечают за активность жгутиков и ресничек.
www.syl.ru
происхождение белков, источники :: SYL.ru
Белки являются составной частью клеток. Им отведена важная роль в природе живых организмов. Белки в питании – ценные и незаменимые компоненты. Какова история их происхождения, в чем различия белков растительного и животного происхождения? Читайте в статье!
История открытия
Название получено от белка яйца. Еще в незапамятные времена человек использовал его для употребления в пищу. Древние римляне, например, применяли его в качестве лечебного средства. Однако белковые вещества начинают свою подлинную историю с появления сведений о протеинах как о химических соединениях.

Учеными были изучены такие их свойства, как свертываемость в результате нагревания, разложение при воздействии на них кислотой, щелочью и другие. Кроме яичного белка, что является веществом животного происхождения, вскоре был охарактеризован полипептид крови. К растительным протеинам относится клейковина из муки пшеницы, которая впервые была получена Беккари. Ученый отметил, что клейковина и белки животного происхождения имеют сходства.
Научные познания по изучению белков как химических веществ расширялись, и уже к XIX веку вышли в свет первые работы в этом направлении.
Что относится к белкам?
Это соединения, большую часть которых составляют аминокислоты. Белки представлены гормонами, ферментами, глобулинами, альбуминами, коллагенами, кератинами и многими другими веществами. Основная их часть поступает в организм человека из пищи животной: молочных продуктов, рыбы, мяса, яиц. Много протеинов содержат бобовые и злаковые культуры. Существуют белки растительного происхождения. Они усваиваются организмом легко. Растительная пища, одако, не содержит многие незаменимые аминокислоты.
Пища, содержащая протеины, при попадании в организм распадается. Образуются аминокислоты, при помощи которых создаются нужные для человека белки. Они участвуют в синтезе ферментов, обеспечивают нормальную работу всех систем организма, являются материалом для создания структуры клеток.

Человеку необходимо всего двадцать аминокислот. Из них организм создает собственные белки. Аминокислоты бывают заменимыми и незаменимыми. Организм производит только первые. Аминокислоты незаменимые организм получает из растительной пищи, но они должны поступать в правильном соотношении.
Белок животного происхождения, содержащийся в мясе, птице, рыбе, яйцах, молоке, по составу аминокислот похож на полипептиды организма человека. Поэтому перечисленные продукты являются полноценными источниками протеина. Незаменимые аминокислоты в них содержатся в полном составе. Из них сам организм создает нужные ему белки. В растительных протеинах содержатся не все незаменимые аминокислоты.
Отличия белков разного происхождения
Протеин для человека очень важен. Если его не хватает, организм стареет, происходит снижение тонуса и мышечной массы, страдают волосы, ногти. Идет ухудшение общего состояния здоровья при недостатке таких соединений, как белки животного происхождения. Продукты содержат только половину необходимых для человека аминокислот. Другая их часть синтезируется организмом самостоятельно.

Животные протеины в своем составе содержат больше аминокислот, чем растительные, которые представляют собой менее ценные белки. Происхождение белков растительных продуктов таково, что они трудно перевариваются, так как заключены в оболочки, состоящие из клетчатки. Какая-то их часть остается непереваренной, из-за чего пищеварительные ферменты не могут оказать на них нужного действия. Кроме того, незаменимые аминокислоты в растительных белках не сбалансированы. Но растительные белки не содержат холестерин.
Существенные недостатки имеют животные белки. Происхождение белков данного вида обуславливает попадание в организм вместе с ними вредных веществ – холестерина и жира, которые опасны для сердца. Поэтому не стоит употреблять жирное мясо, рыбу, молоко, гоняясь за количеством белка.
Протеины одинакового происхождения, например мясные и молочные, отличаются по качеству. В составе белков молока содержатся все аминокислоты, необходимые организму, причем их соотношение оптимальное.
Биологическое значение протеинов мяса неодинаково. Эластин, коллаген являются белками соединительной ткани, их ценность невелика. Более того, эти вещества в избыточном количестве вредны для работы почек. Большей ценностью обладают белки, которые находятся в мышечных тканях. Поэтому употреблять нужно мясо животных с маленьким сроком жизни, то есть молодых. У них коллаген находится в незрелом состоянии.

Соединительной ткани в рыбе меньше, чем в мясе, в пять раз, поэтому она усваивается лучше. Ценным питательным продуктом являются яйца, в которых содержатся белки. Мясные и молочные продукты содержат протеины, которые по отношению друг к другу являются антагонистами. Мясо и молоко не употребляют одновременно.
Организм человека будет получать сбалансированные аминокислоты в нужном количестве, если пищевой рацион будет состоять из белков разного происхождения: животного – на 55 % и растительного – на 45 %. Животные белки усваиваются организмом на 90 %, растительные – только на 60-80 %.
Источники животных белков
Протеины такого происхождения – полноценные. Их ценность зависит от того, насколько сбалансированы аминокислоты, какова степень их перевариваемости и как хорошо они усваиваются организмом. Можно назвать следующие источники белков животного происхождения:
- Мясо. Его протеины – это миозин, актин. Больше всего ценится продукт белого цвета. В нем больше белка и меньше жира. Наиболее ценным считается мясо таких животных, как кролик и цыпленок. Особенно ценится грудка курицы, где на 100 граммов продукта приходится 31 грамм белка. В этом мясе мало жира.
- Говядина. Это мясо красного цвета является ценным источником белка. Но в отдельных его частях содержится жир, вредный для организма.
- Индейка. Белок составляет 25,5 грамма. Это низкокалорийное мясо, содержит мало холестерина. Достоинством продукта являются полезные вещества в его составе. Мясо рекомендуется употреблять беременным женщинам, детям, людям пожилого возраста.

- Кролик. Белок составляет 22 грамма. Мясо богато полезными веществами, которые благотворно влияют на оздоровление всего организма, выводят токсины и радиоактивные вещества. Протеин полностью усваивается.
- Молоко и продукты его переработки. Их белки – лактоглобулины и лактоальбумины — являются самыми ценными. Но увлекаться этими продуктами с большим процентом жирности не следует.
- Морепродукты. Большим содержанием белка отличаются лосось, треска, тунец. В рыбе лососевых пород на 100 граммов продукта 20 приходится на содержание протеина.
- Яйца кур. В них много белка, в одном яйце его содержится 9-11 граммов, причем усваивается он полностью. Холестерин и жир содержатся в небольших количествах.
Как видно, белок содержит и натуральное мясо, и колбаса. Но если питание организовано правильно, белок не следует получать из всех продуктов, содержащих его. От сосисок, колбасы и мяса жирных сортов нужно сразу отказаться. Важно, чтобы организм получал разные белки. Происхождение протеина имеет значение для организма, и лучше их комбинировать.
Чем полезны животные белки?
Употребление пищи, богатой протеинами, положительно сказывается на здоровье человека. Их польза в следующем:
- У людей, регулярно употребляющих домашнюю птицу, рыбу, молочные продукты снижается риск развития заболеваний сердца и сосудов. Реже возникают инсульты.
- Употребление куриных яиц нормализует уровень холестерина и способствует потере лишних килограммов.
- Яйцо на завтрак насыщает организм, человек в течение дня съедает меньше пищи. Особенно это актуально для женщин, следящих за своей фигурой.
- Животный белок способствует увеличению мышечной массы.
Растительные протеины
Источники белков животного и растительного происхождения разные. Основными продуктами растительного происхождения, в которых содержится много протеинов, являются:

- Соя и продукты ее переработки — основной источник растительных белков. Содержание протеина в 100 граммах продукта составляет целых 34 грамма. Недостатком сои является потеря части белка при воздействии высокой температуры. Еще в сое много фитоэстрогенов, поэтому мужчинам не рекомендуется употреблять ее часто и в больших количествах.
- Чечевица. Она является ценным диетическим продуктом, так как содержит мало жира: в 100 граммах всего 1 %.
- Кинва. Эта зерновая культура по содержанию белка лидирует среди растений своего вида. Кроме того, она легко усваивается организмом.
- Семечки тыквы: содержат много белка, третью часть от 100 граммов продукта.
- Миндаль – неоспоримый лидер среди орехов.
Чем полезны растительные белки?
Происхождение белка сказывается на вкусовых качествах продуктов. Растительный протеин вкуснее животного. Он содержится не только в бобовых культурах. Источник белка растительного происхождения — это овощи, фрукты, злаки, орехи, зелень, семечки. Эти натуральные ингредиенты используются для приготовления различных блюд латинской, индийской, азиатской кухни.
В растительных белках немного калорий, поэтому продукты, содержащие их, рекомендованы для употребления людям с лишним весом. Они используются во всех диетах для похудения.
Суточная норма протеинов для человека
Потребность организма в белке зависит от физической активности. Биохимические реакции в организме протекают быстрей, если человек много двигается. Людям, занимающимся спортом, белка нужно в два раза больше, чем тем, которые ведут малоподвижный образ жизни. Если спортсмен испытывает недостаток протеина, происходит иссушение мышц и истощение его организма.

Взрослому мужчине в сутки необходимо 80-100 граммов белка, женщине — 55-60 г, мужчине, занимающемуся спортом – 170-200 г. Норма определяется из расчета 1 грамм белка на 1 килограмм массы тела.
www.syl.ru

